
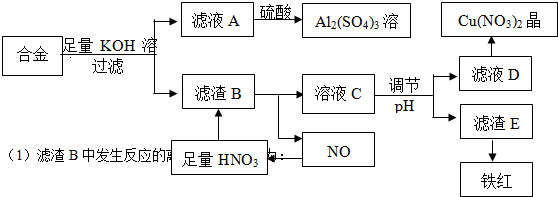
分析 合金与足量KOH作用,反应后所得滤液A为KAlO2,滤渣B为铁和铜,滤液A中加入硫酸得到硫酸铝溶液,滤渣中加入足量的硝酸,得到的溶液C为硝酸铜和硝酸铁的混合物,通过调节溶液pH,使铁离子转化为氢氧化铁沉淀,过滤分离,D为硝酸铜溶液,经蒸发、结晶可得到硝酸铜晶体,氢氧化铁加热分解得到铁红.
(1)Cu与硝酸反应得到硝酸铜、NO与水,Fe与足量的硝酸反应生成硝酸铁、NO与水;
(2)溶液C通过调节pH可以使Fe3+沉淀完全,加入的物质能消耗氢离子,但是不能引入新的杂质;
(3)根据Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-)=4.0×10-38计算c(Fe3+);计算浓度积Qc与Ksp[Cu(OH)2]比较判断;
(4)将20mL Al2(SO4)3溶液与等物质的量浓度的Ba(OH)2溶液70mL混合,则二者的物质的量之比为2:7,钡离子与硫酸根结合为硫酸钡沉淀,硫酸根完全反应,铝离子与氢氧根离子的物质的量之比为1:3.5,所以有部分氢氧化铝转化为偏铝酸根离子,结合原子守恒、电荷守恒配平;
(5)根据反应3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O进行过量计算解答.
解答 解:合金与足量KOH作用,反应后所得滤液A为KAlO2,滤渣B为铁和铜,滤液A中加入硫酸得到硫酸铝溶液,滤渣中加入足量的硝酸,得到的溶液C为硝酸铜和硝酸铁的混合物,通过调节溶液pH,使铁离子转化为氢氧化铁沉淀,过滤分离,D为硝酸铜溶液,经蒸发、结晶可得到硝酸铜晶体,氢氧化铁加热分解得到铁红.
(1)Cu与硝酸反应得到硝酸铜、NO与水,反应离子方程式为:2NO3-+3Cu+8H+=3Cu2++2NO↑+4H2O,
Fe与足量的硝酸反应生成硝酸铁、NO与水,反应离子方程式为:NO3-+Fe+4H+=Fe3++NO↑+2H2O,
故答案为:2NO3-+3Cu+8H+=3Cu2++2NO↑+4H2O,NO3-+Fe+4H+=Fe3++NO↑+2H2O;
(2)溶液C通过调节pH可以使Fe3+沉淀完全,应加入CuO、碱式碳酸铜或氢氧化铜,而加入铜粉生成Fe2+,加入氨水引入新的杂质,
故答案为:CD;
(3)已知溶液的pH=4,则c(H+)=10-4mol/L,c(OH-)=10-10mol/L,Ksp[Fe(OH)3]=4.0×10-38=c(Fe3+)×c3(OH-),所以c(Fe3+)=4.0×10-8mol/L;
溶液中氢氧根离子的浓度为10-10mol/L,则浓度积Qc=c(Cu2+)×c2(OH-)=1×(10-10)2=10-20<Ksp[Cu(OH)2]=2.2×10-20,所以没有氢氧化铜沉淀生成;
故答案:4.0×10-8mol/L;无;
(4)将20mL Al2(SO4)3溶液与等物质的量浓度的Ba(OH)2溶液70mL混合,则二者的物质的量之比为2:7,钡离子与硫酸根结合为硫酸钡沉淀,硫酸根完全反应,铝离子与氢氧根离子的物质的量之比为1:3.5,所以有部分氢氧化铝转化为偏铝酸根离子,结合原子守恒、电荷守恒配平离子方程式为:2Al3++3SO42-+3Ba2++7OH-=3BaSO4↓+Al(OH)3↓+AlO2-+2H2O,
故答案为:2Al3++3SO42-+3Ba2++7OH-=3BaSO4↓+Al(OH)3↓+AlO2-+2H2O;
(5)n(HNO3)=0.1L×2mol/L=0.2mol,n(H2SO4)=0.1L×3mol/L=0.3mol,
则n(H+)=0.2mol+2×0.3mol=0.8mol,n(NO3-)=0.2mol,n(Cu)=0.3mol,
3 Cu+8 H++2 NO3-=3Cu2++2NO↑+4H2O
3 8 2
0.3mol 0.8mol 0.2mol
恰好完全反应,故0.2molNO3-完全被还原;
故答案为:0.2mol.
点评 本题主要考查了物质的分离提纯和制备,题目涉及离子反应方程式的书写、除杂质、氧化还原反应、溶度积的有关计算等,综合性较强,题目难度中等,侧重于考查学生对基础知识的综合应用能力.


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案科目:高中化学 来源: 题型:解答题
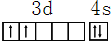 ,其原子核外共有22种运动状态不相同的电子.
,其原子核外共有22种运动状态不相同的电子.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2 L的苯所含的分子个数为0.5NA | |
| B. | 28 g乙烯所含共用电子对数目为4NA | |
| C. | 标准状况下,11.2 L二氯甲烷所含原子个数为2.5NA | |
| D. | 现有乙烯、丙烯、丁烯的混合气体共14 g,其原子个数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
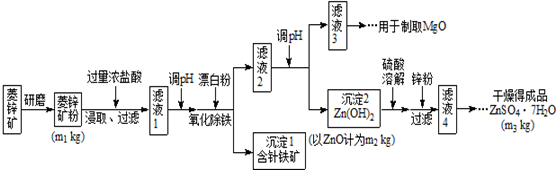
| Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 | |
| 开始沉淀的pH | 10.4 | 6.4 | - | - |
| 沉淀完全的pH | 12.4 | 8.0 | - | - |
| 开始溶解的pH | - | 10.5 | - | - |
| Ksp | 5.6×10-12 | - | 6.8×10-6 | 2.8×10-9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 直链烷烃中,碳原子数越多沸点越高 | |
| B. | 碳原子数相同的烷烃,支链越多沸点越高 | |
| C. | 相对分子质量相近的醇和烷烃相比,醇的沸点远远高于烷烃 | |
| D. | 碳原子数相同的醇,羟基越多沸点越高 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 密度:四氯化碳>乙酸乙酯>水 | |
| B. | 沸点:乙醇>丙烷>乙烷 | |
| C. | 在水中的溶解度:丙三醇>苯酚>1-氯丁烷 | |
| D. | 熔点:对二甲苯>邻二甲苯>间二甲苯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com