
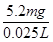 =208 mg��L��1
=208 mg��L��1 =208 mg��L��1
=208 mg��L��1

 ��ɢ˼ά�¿���ϵ�д�
��ɢ˼ά�¿���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��78 g ������̼̼˫������ĿΪ3NA |
| B�����³�ѹ�£�22.4 L������̼���е�ԭ������Ϊ3NA |
| C��1 mol Fe������ϡHNO3��Ӧ��ת��3 NA������ |
| D��1 L 1 mol��L-1��NaClO ��Һ�к���ClO������ĿΪNA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��950 mL��201.4 g | B��1 000 mL��212.0 g |
| C��100 mL��21.2 g | D��500 mL��100.7 g |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������£�11.2 L������ȫ����1 Lˮ�У�������Һ��Cl-��ClO-����������֮��ΪNA |
| B���ܱ������У�0.1 mol H2��25.4 g����һ�������³�ַ�Ӧ������HI������Ϊ0.2 NA |
| C������4 NA��̼̼�Ҽ��Ľ��ʯ��������Ϊ24 g |
| D����0.1 mol FeCl3����Һ��ȫˮ���õ��Ľ������Ӹ���Ϊ0.1 NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���٣��� | B����>�� | C����<�� | D������ȷ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
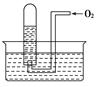
| A��������N2��NO2�Ļ������ |
| B��������O2��NO2�Ļ������ |
| C��������NO��NO2�Ļ������ |
| D��������NO2һ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��9.2 g NO2�����к��з�����ĿΪ0.2NA |
| B����״���£�2.24 L SO3�к�����ԭ����ĿΪ0.3NA |
C��2 g �к����ӡ����ӡ�������Ŀ��ΪNA �к����ӡ����ӡ�������Ŀ��ΪNA |
| D����״����2.24 L Cl2ͨ������ˮ�л�NaOH��Һ�У�ת�Ƶ�����Ŀ��Ϊ0.1NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��0.1 mol/L | B��0.2 mol/L |
| C��0.3 mol/L | D��0.4 mol/L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��c1��2c2 | B��c2<2c1 |
| C��c2>2c1 | D��c2��2c1 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com