
| 10.8g |
| 18g/mol |
| 22g |
| 44g/mol |
 、异戊烷
、异戊烷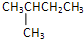 和新戊烷
和新戊烷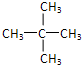 ,
,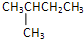 ,
,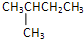 .
.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、Na的熔点比钾的高 |
| B、K与H2O的反应比Na剧烈 |
| C、K在O2中燃烧的产物更为复杂 |
| D、KOH的碱性比NaOH强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在一定条件下,使用催化剂能加快反应速率 |
| B、当反应达平衡时,恒温恒压条件下通入Ar,COCl2的转化率不变 |
| C、单位时间内生成CO和消耗Cl2的物质的量比为1:1时,反应达到平衡状态 |
| D、平衡时,其他条件不变,升高温度可使该反应的平衡常数减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)元素的第一电离能:Al
(1)元素的第一电离能:Al查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 元素X的原子最外层电子数是其内层的3倍.元素Y基态原子的3p轨道上有4个电子.元素Z位于第四周期,ⅡB族.
元素X的原子最外层电子数是其内层的3倍.元素Y基态原子的3p轨道上有4个电子.元素Z位于第四周期,ⅡB族.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 用50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:| 起始温度t1/℃ | 终止温度 T2/℃ |
温度差 △t/℃ | |||
| HCl | NaOH | 平均值 | |||
| 1 | 25 | 25 | 27.3 | ||
| 2 | 25 | 25 | 27.4 | ||
| 3 | 25 | 25 | 28.6 | ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com