

 ,
,分析 短周期元素A、B、C、D、E、F、G原子序数依次递增,B原子的最外层电子数比次外层多3,原子只能有2个电子层,最外层电子数为5,故B为N元素;F与C形成的化合物是制造光导纤维的主要原料,则C为O元素、F为Si;C和G为同一主族元素,则G为S元素;D形成的阳离子和C(氧)形成的阴离子具有相同的核外电子排布,D处于第三周期,A和D为同一主族元素,F(Si)和A可形成化合物FA4很不稳定,可推知A为H元素、D为Na;D的最高价氧化物的水化物为NaOH,E的最高价氧化物的水化物能溶解于NaOH溶液,E的原子序数介于Na、Si之间,则E为Al,G形成的化合物甲为SO2是造成酸雨的主要原因.
(1)E的最高价氧化物水化物为Al(OH)3,存在酸性电离与碱式电离;
(2)G离子为S2-,离子核外有18个电子,有3个电子层,各层电子数为2、8、8;
(3)E的最高价氧化物的水化物为Al(OH)3,D的最高价氧化物的水化物为NaOH,二者反应生成偏铝酸钠与水;
(4)G形成的化合物甲为SO2,与MnO2反应生成MnSO4;
(5)已知一包白色晶体为某种正盐,经元素分析仪分析,包含以上七种元素中的若干种,为测定其组成,进行如下实验:
①称取固体2.37g溶于水,得到无色澄清溶液,再滴加过量的氯化钡溶液和稀盐酸,得到的白色沉淀,则含有SO42-,白色沉淀为BaSO4,其物质的量为$\frac{4.66g}{233g/mol}$=0.02mol,则溶液中n(SO42-)=n(BaSO4)=0.02mol;
②再取等质量的该固体溶于水,逐滴滴加1mol/L的氢氧化钠溶液,开始生成沉淀,最终沉淀完全溶解,则含有Al3+,30mL~40mL时氢氧化铝质量不变,则溶液中还含有NH4+,由Al3++3OH-=Al(OH)3↓可知溶液中n(Al3+)=0.03L×1mol/L×$\frac{1}{3}$=0.01mol,由NH4++OH-=NH3.H2O可知溶液中n(NH4+)=0.01L×1mol/L=0.01mol,m(SO42-)+m(Al3+)+m(NH4+)=0.02mol×96g/mol/L+0.01mol×27g/mol+0.01mol×18g/mol=2.37g,等于样品的质量,故该晶体不含结晶水,晶体中n(SO42-):n(Al3+):n(NH4+)=0.02mol:0.01mol:0.01mol=2:1:1,故该晶体为NH4Al(SO4)2,
往该盐的水溶液中滴加氢氧化钡溶液时,NH4Al(SO4)2与氢氧化钡按物质的量1:2反应时生成沉淀质量达到最大值.
解答 解:短周期元素A、B、C、D、E、F、G原子序数依次递增,B原子的最外层电子数比次外层多3,原子只能有2个电子层,最外层电子数为5,故B为N元素;F与C形成的化合物是制造光导纤维的主要原料,则C为O元素、F为Si;C和G为同一主族元素,则G为S元素;D形成的阳离子和C(氧)形成的阴离子具有相同的核外电子排布,D处于第三周期,A和D为同一主族元素,F(Si)和A可形成化合物FA4很不稳定,可推知A为H元素、D为Na;D的最高价氧化物的水化物为NaOH,E的最高价氧化物的水化物能溶解于NaOH溶液,E的原子序数介于Na、Si之间,则E为Al,G形成的化合物甲为SO2是造成酸雨的主要原因.
(1)E的最高价氧化物水化物为Al(OH)3,电离方程式为:AlO2-+H++H2O?Al(OH)3?Al3++3OH-,
故答案为:AlO2-+H++H2O?Al(OH)3?Al3++3OH-;
(2)G离子为S2-,离子结构示意图为 ,
,
故答案为: ;
;
(3)E的最高价氧化物的水化物为Al(OH)3,D的最高价氧化物的水化物为NaOH,二者反应生成偏铝酸钠与水,反应离子方程式:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(4)G形成的化合物甲为SO2,化合物甲的治理方法之一是用软锰矿浆(主要成分为MnO2)吸收法,该方法能做到“综合治理、变废为宝”,其反应的化学方程式:SO2+MnO2=MnSO4,
故答案为:SO2+MnO2=MnSO4;
(5)已知一包白色晶体为某种正盐,经元素分析仪分析,包含以上七种元素中的若干种,为测定其组成,进行如下实验:
①称取固体2.37g溶于水,得到无色澄清溶液,再滴加过量的氯化钡溶液和稀盐酸,得到的白色沉淀,则含有SO42-,白色沉淀为BaSO4,其物质的量为$\frac{4.66g}{233g/mol}$=0.02mol,则溶液中n(SO42-)=n(BaSO4)=0.02mol;
②再取等质量的该固体溶于水,逐滴滴加1mol/L的氢氧化钠溶液,开始生成沉淀,最终沉淀完全溶解,则含有Al3+,30mL~40mL时氢氧化铝质量不变,则溶液中还含有NH4+,由Al3++3OH-=Al(OH)3↓可知溶液中n(Al3+)=0.03L×1mol/L×$\frac{1}{3}$=0.01mol,由NH4++OH-=NH3.H2O可知溶液中n(NH4+)=0.01L×1mol/L=0.01mol,m(SO42-)+m(Al3+)+m(NH4+)=0.02mol×96g/mol/L+0.01mol×27g/mol+0.01mol×18g/mol=2.37g,等于样品的质量,故该晶体不含结晶水,晶体中n(SO42-):n(Al3+):n(NH4+)=0.02mol:0.01mol:0.01mol=2:1:1,故该晶体为NH4Al(SO4)2,
往该盐的水溶液中滴加氢氧化钡溶液时,NH4Al(SO4)2与氢氧化钡按物质的量1:2反应时生成沉淀质量达到最大值,反应离子方程式为:Al3++NH4++2SO42-+2Ba2++4OH-=Al(OH)3↓+2BaSO4↓+NH3.H2O,
故答案为:NH4Al(SO4)2;Al3++NH4++2SO42-+2Ba2++4OH-=Al(OH)3↓+2BaSO4↓+NH3.H2O.
点评 本题考查结构性质位置关系应用、无机物推断等,侧重考查学生分析推理能力、知识迁移运用能力,(6)中关键是根据反应判断溶液中含有的离子,难度较大.


 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
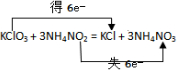 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电镀铜时,电解质溶液中铜离子浓度不断减小 | |
| B. | 电解精炼铜时,电解质溶液中铜离子浓度不变 | |
| C. | 纯锌与稀硫酸反应时,加入少量CuSO4溶液,会使反应速率减慢 | |
| D. | 要使电解后的CuSO4溶液复原,可向其中加人CuO固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有NA个二氧化碳分子 | B. | 含有1molO2 | ||
| C. | 质量为44 g•mol-1 | D. | 所占的体积为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
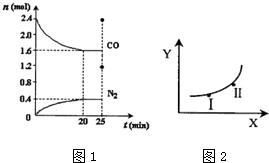
| 条件X | 变量Y | |
| a | 压强 | 反应的平衡常数 |
| b | 温度 | CO的平衡浓度 |
| c | 温度 | N2的体积分数 |
| d | 催化剂 | NO的平衡转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5 mol 1,3-丁二烯分子中含有C=C双键数为 NA | |
| B. | 1 mol羟基(-OH)所含的电子总数为9NA | |
| C. | 14g乙烯、丙烯的混合气体中所含原子总数为3NA | |
| D. | 标准状况下,1L庚烷完全燃烧所生成的气态产物的分子数为7/22.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无论在什么条件下,c(H+)增大,酸性都增强 | |
| B. | 稀释氯化铵溶液,水的电离程度变大 | |
| C. | 稀释氢氧化钠溶液,水的电离程度变小 | |
| D. | 升高温度,KW变大,H+浓度增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com