
【题目】常温下,用盐酸酸化的FeCl3溶液腐蚀铜制线路板,分别取腐蚀后的滤液并向其中加入指定物质,反应后的溶液中主要存在的一组离子正确的是
A.通入过量Cl2:Fe3+、H+、Cu2+、Cl
B.加入过量SO2:Fe3+、H+、Cu2+、![]() 、Cl
、Cl
C.加入过量NaOH溶液:Na+、Fe2+、OH、Cl
D.加入过量CuO:Fe2+、H+、Cu2+、Cl、
科目:高中化学 来源: 题型:
【题目】某含锰矿物的主要成分有MnCO3、MnO2、FeCO3、SiO2、Al2O3等。已知FeCO3、MnCO3难溶于水。一种运用阴离子膜电解法的新技术可用于从碳酸锰矿中提取金属锰,主要物质转化关系如下:

(1)设备1中反应后,滤液1里锰元素只以Mn2+的形式存在,且滤渣1中也无MnO2。滤渣1的主要成分是 (填化学式)。
(2)设备1中发生氧化还原反应的离子方程式是 。
(3)设备2中加足量双氧水的作用是 。设计实验方案检验滤液2中是否存在Fe2+: 。
(4)设备4中加入过量氢氧化钠溶液,沉淀部分溶解,。用化学平衡移动原理解释原因: 。
(5)设备3中用阴离子膜法提取金属锰的电解装置图如下:

① 电解装置中箭头表示溶液中阴离子移动的方向,则A电极是直流电源的 极。实际生产中,阳极以稀硫酸为电解液,阳极的电极反应式为 。
② 该工艺之所以采用阴离子交换膜,是为了防止Mn2+进入阳极区发生副反应生成MnO2造成资源浪费,写出该副反应的电极反应式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,32g金属铜与足量某浓度的硝酸完全反应,生成NO2和NO的物质的量之比为1∶3,则反应过程中转移的电子为( )
A.1 mol B.2 mol C.3mol D.4 mo1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属晶体和离子晶体的说法中错误的是 ( )
A. 都可采取“紧密堆积”的结构B. 都含离子
C. 一般具有较高的熔点和沸点D. 都能导电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为解决能源短缺问题,工业生产中应合理利用化学能。
(1)25 ℃,1.01×105 Pa时,实验测得,4 g氢气在O2中完全燃烧生成液态水,放出572 kJ的热量,则表示H2的燃烧热的热化学方程式为______________________。
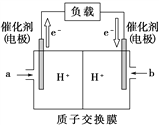
(2)上图是某笔记本电脑使用的甲醇燃料电池的结构示意图。放电时甲醇应从________处通入(填“a”或“b”),电池内部H+向_______(填“左”或“右”)移动。写出电池负极的电极反应式________。正极的电极反应式_______________________。
(3)从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。
化学键 | H—H | N—H | N≡N |
键能/kJ·mol-1 | 436 | a | 945 |
已知:N2(g)+3H2(g)===2NH3(g) ΔH=-93 kJ·mol-1。
试根据表中所列键能数据计算a的数值________。
当可逆反应中净生成N—H物质的量为2mol 时,反应放热_____________。
(4)已知:C(s,石墨)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1 ①
2H2(g)+O2(g)===2H2O(l) ΔH2=-571.6 kJ·mol-1 ②
2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH3=-2599 kJ·mol-1 ③
根据盖斯定律,计算反应2C(s,石墨)+H2(g)===C2H2(g)的ΔH=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
选项 | 实验 | 解释或结论 |
A | 向溶液X中滴加盐酸无明显现象,再滴加BaCl2溶液有白色沉淀生成 | X中含有 |
B | 用洁净的玻璃管向包有Na2O2的脱脂棉吹气,脱脂棉燃烧 | CO2、H2O与Na2O2反应是放热反应 |
C | 向1 mL 1% NaOH溶液加入2 mL 2%的CuSO4溶液,振荡后滴加0.5 mL5%葡萄糖溶液,加热未出现红色沉淀 | 葡萄糖中不含醛基 |
D | 将硫酸酸化的H2O2滴入Fe(NO3)2溶液,溶液变黄色 | H2O2的氧化性比Fe3+强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷在空气中燃烧生成二氧化碳和水,同时产生淡蓝色火焰,下列说法正确的是
A. 形成H-O键吸收能量 B. 该反应是吸热反应
C. 断裂C-H键放出热量 D. 该反应是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组在实验室中模拟上述过程,其设计的模拟装置如下:

根据设计要求回答:
(1)A装置中发生反应的离子方程式是______________________________;
(2)B装置有三种功能:①___________,②显示气流速度,③均匀混合气体;
(3)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式_________________________;
(4)D装置的石棉浸有KI溶液,其作用是_______________;
(5)E装置除生成盐酸外,还含有有机物,从E中分离出盐酸的操作名称为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】既可用于鉴别乙烷和乙烯,又可用于除去乙烷中的乙烯以得到乙烷的方法是( )
A. 通过足量的氢氧化钠溶液B. 通过足量的溴水
C. 通过足量的酸性高锰酸钾溶液D. 通过足量的浓盐酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com