
 2015��8��12��23��30���ң�������������һ����װ����ͷ������ը��������ը���Ǽ�װ���ڵ���ȼ�ױ���Ʒ�軯�ƣ�����Ϊ700�����ң�
2015��8��12��23��30���ң�������������һ����װ����ͷ������ը��������ը���Ǽ�װ���ڵ���ȼ�ױ���Ʒ�軯�ƣ�����Ϊ700�����ң�
���� ��1��NaCNΪǿ�������Σ�����ˮ��CN-ˮ������HCN���������ƣ�������Һ�Լ��ԣ�
��2����ʹʪ��ĺ�ɫʯ����ֽ����������Ϊ����������ԭ���غ㣬ͬʱ����̼�����ƣ�
�ڸ���ԭ���غ�͵���غ���
��3���ٷǽ���Ԫ���γɹ��ۼ�ʱ�����õ��Ӷ�ƫ��ǽ�����ǿ��Ԫ�أ����Էǽ�����ǿ��Ԫ���Ը��ۣ��ǽ��������������ۣ�
�ڸ�����Ϣ��CN-�ܹ�������������HCO3-��ͬʱ����NH3����д����ʽ��
��A���õ������Һ�ʼ��ԣ����ʱ���ò����ý�����ǽ����������������ýϲ����ý�����������
B��������������ʧ�����������������������������ӷ�Ӧ���ɴ���������Ӻ�ˮ��
C��������ˮʧ�����������������������ӣ�
D������������ClO-��CN-����Ϊ��������Ⱦ�����壬�÷�Ӧ�ڼ��������½��У�����Ӧ�����������������ɣ�
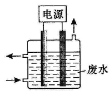
��4��˫��ˮ��̼���ƻ�Ͽ����¶ȷ�����Ӧ2Na2CO3 ��aq��+3H2O2 ��aq��?2Na2CO3•3H2O2��s�������ù��˵õ�����2Na2CO3•3H2O2��������ϴ�ӡ�����õ��ϴ�����2Na2CO3•3H2O2��
�ٹ�̼�����൱�ڴ��ᾧ˫��ˮ��̼���ƣ�����˫��ˮ�����ʣ���������ԭ�������״ٽ���̼���Ʒ�Ӧ������ʧЧ��
����д����Ӧ�Ļ�ѧ����ʽ��Ȼ�����˫��ˮ�������ص����ʵ�����ϵ�������Ʒ��˫��ˮ�İٷֺ�����
��� �⣺��1��NaCNΪǿ�������Σ�����ˮ��CN-ˮ������HCN���������ƣ�ˮ������ӷ���ʽ��CN-+H2O?HCN+OH-��
�ʴ�Ϊ��CN-+H2O?HCN+OH-��
��2������˫��ˮ�����軯�ƣ�����һ����ʹʪ��ĺ�ɫʯ����ֽ����������Ϊ����������ԭ���غ�һ����ʽ��Ϊ̼�����ƣ����Է�ӦΪ��NaCN+H2O2+H2O�TNaHCO3+NH3����
�ʴ�Ϊ��NaCN+H2O2+H2O�TNaHCO3+NH3����
��CN-+S2O32-�TA+SO32-�����ݵ���غ㣬AΪ-1�۵������ӣ�����ԭ���غ㣬A�к���1����ԭ�ӡ�1��̼ԭ�ӡ�1����ԭ�ӣ�����AΪ��SCN-��
�ʴ�Ϊ��SCN-��
��3����CN-��CԪ����+2�ۣ�NԪ����-3�ۣ�˵��N�ǽ�����ǿ��
�ʴ�Ϊ������
��CN-�ܹ�������������HCO3-��ͬʱ����NH3�ó�����ʽΪ��2CN-+4H2O+O2$\frac{\underline{\;����\;}}{\;}$2HCO3-+2NH3��
�ʴ�Ϊ��2CN-+4H2O+O2$\frac{\underline{\;����\;}}{\;}$2HCO3-+2NH3��
��A���õ������Һ�ʼ��ԣ����ʱ���ò����ý�����ǽ����������������ýϲ����ý��������������Կ�����ʯī����������������������A��ȷ��
B��������������ʧ�����������������������������ӷ�Ӧ���ɴ���������Ӻ�ˮ������������ӦʽΪCl-+2OH--2e-�TClO-+H2O����B��ȷ��
C���������Һ�ʼ��ԣ���������ˮʧ�����������������������ӣ��缫��ӦʽΪ2H2O+2e-�TH2��+2OH-����C��ȷ��
D������������ClO-��CN-����Ϊ��������Ⱦ�����壬��������Ϊ������̼�͵������÷�Ӧ�ڼ��������½��У�����Ӧ�����������������ɣ���Ӧ����ʽΪ2CN-+5ClO-+H2O�TN2��+2CO2��+5Cl-+2OH-����D����
�ʴ�Ϊ��D��
��4���ٹ�̼�����൱�ڴ��ᾧ˫��ˮ��̼���ƣ�����˫��ˮ�����ʣ�FeCl3����˫��ˮ�ֽ�Ĵ�����KCN���л�ԭ�ԣ��ܱ���̼����������CuSO4��˫��ˮ�ķֽ⣬�����Ʋ����̼���Ʒ�Ӧ��
�ʴ�Ϊ��C��
�ڸ��������Һ���̼���Ʒ�Ӧ�Ļ�ѧ����ʽΪ��6KMnO4+5��2Na2CO3•3H2O2��+19H2SO4�T3K2SO4+6MnSO4+10Na2SO4+10CO2��+15O2��+34H2O���ζ�����������2.000x10-2 mol•L-1 KMnO4����Һ�����ʵ���Ϊ��2.000x10-2 mol•L-1��0.03L=6.000x10-4mol��
��������������Ϊxg�����ݹ�ϵʽ
KMnO4��2Na2CO3•3H2O2��15H2O2
6mol 15��34g
6.000x10-4mol x
x=0.051
�����������������=$\frac{0.051g}{0.2g}$=25.50%
�ʴ�Ϊ��25.50%��
���� ���⿼���˹�̼���Ƶ�ʵ�鷽������ѧ����ʽ��д���������������ļ����֪ʶ����Ŀ�ѶȽϴ�ע�⻯ѧʵ��ԭ�����ܹ����ݷ�Ӧ����ʽ���мĻ�ѧ���㣬����������ѧ���ķ������������������Ӧ����ѧ֪ʶ��������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ��ѧʽ | ���볣����25�棩 |
| HCN | K=4.9��10-10 |
| CH3COOH | K=1.8��10-5 |
| H2CO3 | K1=4.3��10-7��K2=5.6��10-11 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �¶�/�� | 200 | 300 | 400 |
| K | 1.0 | 0.85 | 0.5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 =2Cr��OH��3��+3O2��+2H2O
=2Cr��OH��3��+3O2��+2H2O�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ʵĻ�ԭ�ԣ�W��Y | |
| B�� | ����������Ӧ��ˮ��������ԣ�X��Z | |
| C�� | W�������Ӻ�Z�������Ӿ��ܴٽ�ˮ�ĵ��� | |
| D�� | ��W��Y��Z����Ԫ����ɵĻ�����Ⱥ����Ӽ��ֺ����ۼ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
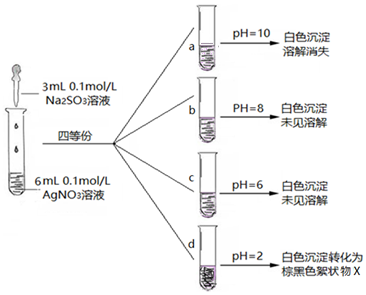
| ʵ�� | ���� | ���� |
| �� | ���������Թ��м�ϡ���ᡢ�۲� | ���������� |
| �� | ���������Թ��м�����Ũ���ᡢ�۲� | ������������ɫ���� |
| �� | �ڢ���Ӧ������Һ�У���Ba��NO3��2��Һ���۲죬�ټ�BaCl2���۲� | ǰ�������������߳��ְ�ɫ���� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com