
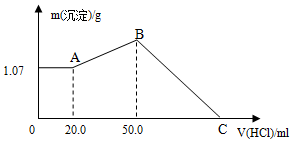
 把NaOH、FeCl3、AlCl3三种固体组成的混合物溶于足量水后,产生1.07g白色沉淀,再向所得悬浊液中逐滴加入1mol/L HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示.试回答:
把NaOH、FeCl3、AlCl3三种固体组成的混合物溶于足量水后,产生1.07g白色沉淀,再向所得悬浊液中逐滴加入1mol/L HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示.试回答:分析 固体组成的混合物溶于足量水后,再加入盐酸时,0-A时沉淀的质量不变,说明溶液中NaOH过量,加入20 mL 盐酸恰好中和过量的NaOH,再加盐酸沉淀增多,说明AlO2-转化为Al(OH)3,则A点沉淀物为 Fe(OH)3,AB段发生反应:AlO2-+2H2O+H+=Al(OH)3↓,B点溶液中存在的溶质是氯化钠,沉淀为Fe(OH)3、Al(OH)3;BC段发生反应:Al(OH)3+3H+=Al3++3H2O、Fe(OH)3+3H+=Fe3++3H2O,据此进行解答.
解答 解:固体组成的混合物溶于足量水后,再加入盐酸时,0-A时沉淀的质量不变,说明溶液中NaOH过量,加入20 mL 盐酸恰好中和过量的NaOH,再加盐酸沉淀增多,说明AlO2-转化为Al(OH)3,则A点沉淀物为 Fe(OH)3,AB段发生反应:AlO2-+2H2O+H+=Al(OH)3↓,B点溶液中存在的溶质是氯化钠,沉淀为Fe(OH)3、Al(OH)3;BC段发生反应:Al(OH)3+3H+=Al3++3H2O、Fe(OH)3+3H+=Fe3++3H2O,
(1)根据分析可知,A点沉淀为Fe(OH)3,B点沉淀为Al(OH)3,
故答案为:Fe(OH)3;Al(OH)3;
(2)A点沉淀的是Fe(OH)3,则n[Fe(OH)3]=$\frac{1.07g}{107g/mol}$=0.01mol,根据Fe原子守恒得n(FeCl3)=n[Fe(OH)3]=0.01mol;
AB段发生反应:AlO2-+2H2O+H+=Al(OH)3↓,则n[Al(OH)3]=n(HCl)=1mol/L×(0.05-0.02)L=0.03mol,根据铝原子守恒得n(AlCl3)=n[Al(OH)3]=0.03mol,
B点溶质为NaCl,由Na+离子和Cl-离子守恒得,原混合物中n(NaOH)=n(NaCl)=n(Cl-)=3n(FeCl3)+3n(AlCl3)+n(HCl)=0.01mol×3+0.03mol×3+0.05×1mol/L=0.17mol,
答:原混合物中n(AlCl3)=0.03mol、n(FeCl3)=0.01mol、n(NaOH)=0.17mol;
(3)C溶液中溶质为NaCl、MgCl2、AlCl3,加入盐酸等于原混合物中NaOH消耗的盐酸体积,二者恰好反应时:n(HCl)=n(NaOH)=0.17mol,则C点处的盐酸的体积为:V[HCl(aq)]=$\frac{0.17mol}{1mol/L}$=0.17L=170mL,
答:C点处的盐酸的体积为170mL.
点评 本题考查了混合物反应的计算,题目难度中等,明确曲线变化趋势及每段发生的化学反应为解本题关键,注意掌握质量守恒定律在化学计算中的应用.


 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 | |
| B. | 由C(石墨)=C(金刚石);△H=+1.90 kJ•mol-1可知,金刚石比石墨稳定 | |
| C. | 在稀溶液中,H+(aq)+OH-(aq)=H2O(l);△H=-57.3 kJ•mol-1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热大于57.3 kJ | |
| D. | 在101 kPa时,2 g H2 完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l);△H=-285.8 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝的密度小 | B. | 铝表面能形成致密的氧化膜 | ||
| C. | 常温下铝不能与氧气反应 | D. | 铝的化学性质不活泼 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属铝溶于氢氧化钠溶液:Al+2OH-═2AlO2-+H2↑ | |
| B. | AlCl3溶液中加入足量的氨水:Al3++4OH-═AlO2-+2H2O | |
| C. | 过氧化钠与水反应:Na2O2+2H2O═2Na++2OH-+O2↑ | |
| D. | FeCl2溶液跟Cl2反应:2Fe2++Cl2═2Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CO2、SO2、NOx是对环境影响较大的气体,控制和治理CO2、SO2、NOx是解决温室效应、减少酸雨和光化学烟雾的有效途径.
CO2、SO2、NOx是对环境影响较大的气体,控制和治理CO2、SO2、NOx是解决温室效应、减少酸雨和光化学烟雾的有效途径.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+ K+ SO42- AlO2- | B. | Ca2+ Na+ SO42- Cl- | ||
| C. | Na+ K+ SO42- NO3- | D. | K+ Na+ MnO4- SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 试剂组 | 结论 |
| ① | NaOH溶液、酚酞试液 | |
| ② | Na2CO3溶液、酚酞试液 | |
| ③ | 碘水、淀粉溶液 | |
| ④ | KMnO4溶液、稀硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
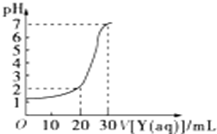 如图为常温下10mL一定物质的量浓度的盐酸X,用一定物质量浓度的NaOH溶液Y滴定的图示,据图推出NaOH溶液和盐酸的物质的量浓度正确的是( )
如图为常温下10mL一定物质的量浓度的盐酸X,用一定物质量浓度的NaOH溶液Y滴定的图示,据图推出NaOH溶液和盐酸的物质的量浓度正确的是( )| A | B | C | D | |
| HCl(mol/L) | 0.12 | 0.04 | 0.09 | 0.12 |
| NaOH(mol/L) | 0.04 | 0.12 | 0.03 | 0.06 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com