
| A、OH- |
| B、Ag+ |
| C、Na+ |
| D、Ca2+ |


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
| A、常温下,NaCl(aq)+H2O(1)+CO2(g)+NH3(g)═NaHCO3(s)+NH4Cl(aq)能自发进行,则该反应的△H<0 |
| B、在等浓度NaCl和KI溶液中滴加AgNO3溶液,先产生白色沉淀 |
| C、等物质的量浓度的HA与NaA溶液等体积混合后,混合溶液不一定显酸性 |
| D、对于某△H<0的反应,加热能使该反应的反应速率和平衡常数均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、P、S、Cl元素最高正价依次升高 |
| B、N、O、F第一电离能依次增大 |
| C、Na、Mg、Al原子最外层电子数依次增多 |
| D、Na、K、Rb电负性逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2NA个HF分子所占的体积约为44.8L |
| B、46 g四氧化二氮和二氧化氮的混合气体中含有的原子数少于3NA |
| C、常温常压下,8.8 gCO2和N2O混合气体中所含的电子数为4.4NA |
| D、5.6 g铁与500 mL 2 mol?L-1硝酸反应,转移的电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在一定条件下,催化分解80 g SO3所得混合气体中氧原子数为3NA |
| B、一定条件下,铁与水蒸气反应生成8.96L(已折合成标准状况)H2时,转移的电子数为0.8NA |
| C、将100mL1mol/L AlCl3与100mL3mol/L NaCl溶液混合后,Cl-的个数为0.6NA |
| D、含有非极性键的数目为NA的Na2O2与水充分反应产生标准状况下22.4LO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、摩尔是一个单位而非物理量 |
| B、摩尔既能用来计量纯净物,又能用来计量混合物 |
| C、1mol任何气体所含气体的分子数目都相等 |
| D、H2的摩尔质量是2g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、葡萄糖的结构简式:C6H12O6 | ||
| B、NaHCO3的电离:NaHCO3═Na++H++CO32- | ||
C、质子数为53、中子数为78的碘原子:
| ||
D、CO2的电子式: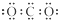 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com