
在25℃时若10体积某强酸溶液与1体积的某强碱溶液混合后溶液是碱性,则混合前,该强酸的溶液的pHX与该强碱溶液的pHY之间应满足的关系是______。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
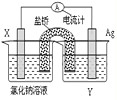 运用化学反应原理研究以下问题:
运用化学反应原理研究以下问题: 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
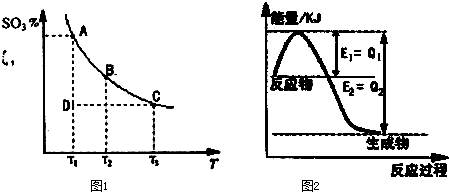
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com