
【题目】碲(Te)为第VIA元素,其单质凭借优良的性能成为制作合金添加剂、半导体、光电元件的主体材料,并被广泛应用于冶金、航空航天、电子等领域。可从精炼铜的阳极泥(主要成分为Cu2Te)中回收碲,工艺流程如下 :
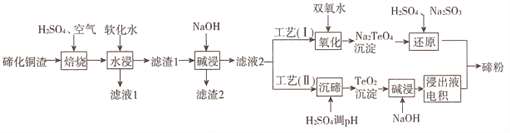
(1)“焙烧”后,碲主要以TeO2 形式存在,写出相应反应的化学方程式:_____________。
(2)为了选择最佳的焙烧工艺,进行了温度和硫酸加入量的条件试验,结果如下表所示:
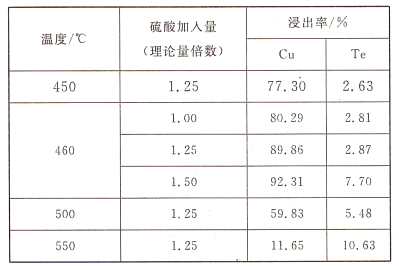
则实验中应选择的条件为_______________,原因为_______________。
(3)工艺( I)中,“还原”时发生的总的化学方程式为_______________。
(4)由于工艺(I)中“氧化”对溶液和物料条件要求高,有研究者采用工艺(II)获得碲。则“电积”过程中,阴极的电极反应式为_______________。
(5)工业生产中,滤渣2经硫酸酸浸后得滤液3和滤渣3。
①滤液3 与滤液1合并,进入铜电积系统。该处理措施的优点为________________。
②滤渣3中若含Au和Ag,可用__________将二者分离。(填字母)
A.王水 B.稀硝酸 C.浓氢氧化钠溶液 D.浓盐酸
【答案】 Cu2Te+2H2SO4+2O2![]() 2CuSO4+TeO2+2H2O 460℃、硫酸用量为理论量的1.25倍 该条件下,铜的浸出率高且碲的损失较低 Na2TeO4+3Na2SO3+H2SO4=4Na2SO4+Te+H2O TeO32-+4e-+3H2O=Te+6OH- CuSO4溶液回收利用,提高经济效益 B
2CuSO4+TeO2+2H2O 460℃、硫酸用量为理论量的1.25倍 该条件下,铜的浸出率高且碲的损失较低 Na2TeO4+3Na2SO3+H2SO4=4Na2SO4+Te+H2O TeO32-+4e-+3H2O=Te+6OH- CuSO4溶液回收利用,提高经济效益 B
【解析】流程分析:流程的目的为从精炼铜的阳极泥(主要成分为Cu2Te)中回收碲,则要先除杂。步骤1,培烧Cu2Te,通入氧气将Cu2Te氧化;步骤2,水浸,根据流程可知Te元素进入滤渣1,CuSO4进入滤液1,Cu和Te分离。可推断,步骤1中Cu被氧化为CuO后被硫酸溶解,生成易溶于水的硫酸铜,而Te以微溶于水的TeO2形式存在。步骤3,碱浸,Te元素进入滤液2,则TeO2与NaOH反应生成易溶于水的盐。
(1)碲(Te)为第VIA元素,则Te最低化合价为-2价,所以Cu2Te中Cu为+1价,Te为-2价。培烧时通入空气,加入硫酸,生成物中Te主要以TeO2形式存在,Te被氧化为+4价,Cu被氧化为+2价,根据元素守恒,硫酸将Cu溶解生成硫酸铜。利用化合价升降守恒可配平得方程式为:Cu2Te+2H2SO4+2O2![]() 2CuSO4+TeO2+2H2O。
2CuSO4+TeO2+2H2O。
故答案为:Cu2Te+2H2SO4+2O2![]() 2CuSO4+TeO2+2H2O;
2CuSO4+TeO2+2H2O;
(2)培烧的主要目的为将Cu元素转变为易溶于水CuSO4的,将Te元素转变为微溶于水的TeO2,从而达到分离Cu与Te的目的。所以培烧加硫酸的过程中,应提高Cu的浸出率,降低Te的浸出。分析表格数据可知,当硫酸的量一定时,温度升高,铜的浸出率降低;温度一定时,铜和Te的浸出率均增大。“460℃、硫酸用量为理论量的1.25倍”的条件最佳,因为该条件下,铜的浸出率高且碲的损失较低。
故答案为:460℃、硫酸用量为理论量的1.25倍;该条件下,铜的浸出率高且碲的损失较低。
(3)碲(Te)为第VIA元素,可以类比S元素进行解题。类比SO2与NaOH的反应可知,碱浸过程中发生的反应为:TeO2+2NaOH= Na2TeO3+H2O。工艺(I)中,加入双氧水,Na2TeO3被氧化为Na2TeO4沉淀。再加入Na2SO3,Na2TeO4被还原为Te单质。还原过程的方程式为:Na2TeO4+3Na2SO3+H2SO4=4Na2SO4+Te+H2O。
故答案为:Na2TeO4+3Na2SO3+H2SO4=4Na2SO4+Te+H2O;
(4)工艺(II)中,浸出液主要溶质为Na2TeO3,阴极得电子,化合价降低,被还原,则阴极反应为:TeO32-+4e-+3H2O=Te+6OH-。
故答案为:TeO32-+4e-+3H2O=Te+6OH-。
(5)①培烧、水浸后滤渣2中还有未浸出的铜,再次加硫酸溶解后得到硫酸铜,过滤后滤液3中主要成分为硫酸铜,与滤液1中的硫酸铜合并,进入铜电积系统,提取铜,该措施有效回收利用了硫酸铜,提高了经济效益;②Au和Ag都能溶于王水,不能用王水分离银、金;Ag溶于稀硝酸,Au不溶于硝酸,可以将二者分离;浓NaOH、浓盐盐酸都不与Ag、Au反应,不能将金、银分离。
故答案为:CuSO4溶液回收利用,提高经济效益;B。


科目:高中化学 来源: 题型:
【题目】下列反应中一定属于吸热反应的是( )
A.需加热或点燃才能引发的反应
B.氧化还原反应
C.氢氧化钡晶体和氯化铵晶体混合搅拌
D.一氧化碳和氧气反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向偏铝酸钠溶液中逐滴加入盐酸,溶被的pH值随着加入盐酸体积的变化曲线如图所示,则下列说法正确的是
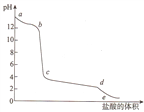
A. a~b段的主要离子方程式为A102-+4H+=Al3++2H2O
B. 向c点溶液中滴加氨水,发生的离子方程式为A13++30H-=Al(OH)3↓
C. c~d段的主要离子方程式为Al(OH)3+3H+= A13++3H2O
D. 向c点溶液中加入碳酸钠,发生的离子方程式为2 A13++CO32-+3H2O =2Al(OH)3↓+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料. 
(1)写出A在加热条件下与H2反应的化学方程式
(2)写出E与A的氢化物反应生成A的化学方程式
(3)写出一个由D生成B的化学方程式;
(4)将5mL0.10molL﹣1的E溶液与10mL0.10molL﹣1的NaOH溶液混合. ①写出反应的离子方程式;
②反应后溶液的pH7(填“大于”、“小于”或“等于”),理由是;
③加热反应后的溶液,其pH(填“增大”、“不变”或“减小”),理由是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为一原电池的结构示意图,下列说法中,错误的是( ) 
A.Cu电极为正电极
B.原电池工作时,电子从Zn电极流出
C.原电池工作时的总反应为:Zn+Cu2+=Zn2++Cu
D.盐桥(琼脂﹣饱和KCl溶液)中的K+移向ZnSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【选修3:物质结构与性质】铜元素可形成多种重要化合物。回答下列问题:
(1)铜元素位于元素周期表中的_____区,其基态原子的价电子排布图为_________。
(2)往硫酸铜溶液中加入过量氨水,可形成[Cu(NH3)4]SO4溶液,该溶液可用于溶解纤维素。
①[Cu(NH3)4]SO4中阴离子的立体构型是__________。
②在[Cu(NH3)4]SO4中,Cu2+与NH3之间形成的化学键称为______,提供孤电子对的成键原子是_________。
③除硫元素外,[Cu(NH3)4]SO4中所含元素的电负性由小到大的顺序为________。
④NF3与NH3的空间构型相同,中心原子的轨道杂化类型均为_________。但NF3不易与Cu2+形成化学键,其原因是_______________。
(3)一种Hg-Ba-Cu-O高温超导材料的晶胞(长方体)如图所示。

①该物质的化学式为__________。
②已知该晶胞中两个Ba2+的间距为cpm.则距离Ba2+最近的Hg+数目为_____个,二者的最短距离为_______pm。(列出计算式即可,下同)
③设该物质的摩尔质量为M,阿伏加德罗常数的值为NA,则该晶体的密度为______g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H、C、N、C、Na、S、Fe是中学化学中常见的元素,请根据题意回答与这些元素有关的问题:
(1)Fe元素在元素周期表中的位置:___________________;
(2) 写出(CN)2的电子式: __________________;
(3)用电子式表示Na3N 的形成过程: __________________;
(4)各种氮氧化物(NO、NO2)是主要的大气污染物之一,治理氨氧化物(NOx)废气的方法之一是用NaOH溶液进行吸收,其反应原理可表示如下:
NO2 +NO+2NaOH=2NaNO2+H2O 2NO2 + 2NaOH =NaNO2+NaNO3+H2O
现有NO 与NO2的混合气体,将其通入50 mL 2 mol/L的NaOH 溶液中,恰好完全吸收,测得溶液中含有NO3-0.02 mol,混合气体中v(NO): v(NO2)=_________;
(5) 向FeI2溶液中不断通入Cl2,溶液中I-、I2、IO3-、Fe3+、Fe2+等粒子物质的量随n(Cl2)/n(FeI2 )的变化可用下图简单表示
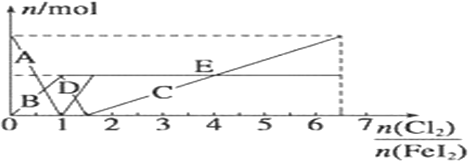
当n(Cl2)/n(FeI2 )=6.5 时,溶液中n(Cl-):n(IO3-)=_________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用右图所示装置可以将温室气体CO2转化为燃料气体CO。下列说法中,不正确的是
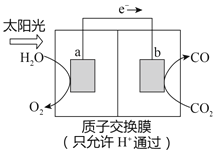
A. 电极b表面发生还原反应
B. 该装置工作时,H+从a极区向b极区移动
C. 该装置中每生成1molCO,同时生成0.5molO2
D. 该过程是将化学能转化为电能的过程
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com