
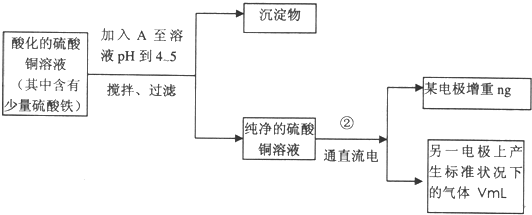

| ||
| ||
| 11200n |
| V |
| 11200n |
| V |
| ||
| ||
| ||
| V×10-3L |
| 22.4L/mol |
| V×10-3L |
| 22.4L/mol |
| 11200n |
| V |
| 11200n |
| V |


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:高中化学 来源: 题型:
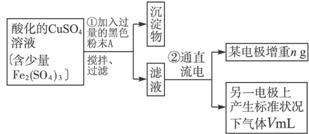
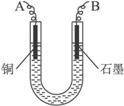
图4-16
试回答下列问题:
(1)步骤①所加入的A的化学式为________________,加入A的作用是___________________,
(2)步骤②中所用部分仪器如图4-16所示,则A应接直流电源的__________极。
(3)电解开始后一段时间,在U形管内可观察到的现象是____________,其电解总反应的离子方程式为________________________。
(4)下列实验操作属必要的是__________(填字母,下同),属不必要的是________________。
A.称量电解前电极的质量
B.电解后电极在烘干、称量前,必须用蒸馏水冲洗
C.刮下电解后电极上的铜,并清洗、称量
D.电极在烘干称量的操作必须按烘干→称量→再烘干→再称量进行两次
E.在有空气存在的情况下,电极烘干必须采用低温烘干法
(5)铜的相对原子质量为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
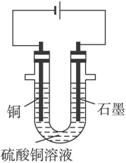
(1)向含有少量Fe2(SO4)3和稀H2SO4的CuSO4溶液中,加入稍过量的黑色粉末A搅拌、过滤,得到较纯净的CuSO4溶液。A的化学式为______________,加入A的作用是__________________________。
(2)将较纯净的CuSO4溶液放入上图所示的装置中进行电解,石墨电极上的电极反应式为_____________,电解反应的离子方程式为__________________________。
(3)实验完成后,石墨电极产生标准状况下的气体V mL,铜电极增重a g,则Cu的相对原子质量(用带有a、V的计算式表示)为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知在pH为4—5的环境中,Cu2+几乎不水解,而Fe3+几乎完全水解。某学生欲用电解纯净CuSO4溶液的方法,并根据电极上析出铜的质量以及电极上产生气体的体积来测定铜的相对原子质量。其实验流程如下:
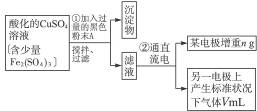
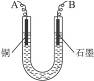
图4-16
试回答下列问题:
(1)步骤①所加入的A的化学式为________________,加入A的作用是___________________,
(2)步骤②中所用部分仪器如图4-16所示,则A应接直流电源的__________极。
(3)电解开始后一段时间,在U形管内可观察到的现象是____________,其电解总反应的离子方程式为________________________。
(4)下列实验操作属必要的是__________(填字母,下同),属不必要的是________________。
A.称量电解前电极的质量
B.电解后电极在烘干、称量前,必须用蒸馏水冲洗
C.刮下电解后电极上的铜,并清洗、称量
D.电极在烘干称量的操作必须按烘干→称量→再烘干→再称量进行两次
E.在有空气存在的情况下,电极烘干必须采用低温烘干法
(5)铜的相对原子质量为______________________。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年山东省潍坊市寿光市高三(上)期末化学试卷(解析版) 题型:解答题
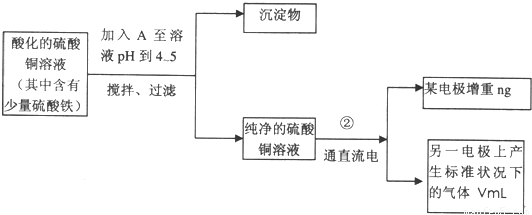
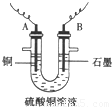
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com