
| A、c(SO42-)>c(H+)>c(NH4+)>c(OH-) |
| B、c(H+)>c(SO42-)>c(NH4+)>c(OH-) |
| C、c(OH-)-c(NH4+)=c(H+)-2c(SO42-) |
| D、c(OH-)+c(NH3?H2O)=c(H+)-c(SO42-) |


科目:高中化学 来源: 题型:
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
周期 族 |
IA | IIA | IIIA | IVA | VA | VIA | VIIA | O |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑾ | ? |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、Cl-的结构示意图为 |
| B、D216O中,质量数之和是质子数之和的两倍 |
| C、在氮原子中,质子数为7而中子数不一定为7 |
| D、Be2+中的电子数和质子数之比一定为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,22.4L CH4中含有的C-H键数为4NA |
| B、4.6g由NO2和N2O4组成的混合气体中含有的氧原子数为0.3NA |
| C、含0.2mol H2SO4的浓硫酸与足量Cu反应,生成SO2的分子数为0.1NA |
| D、1mol Na在足量O2中燃烧生成Na2O2,钠失去的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
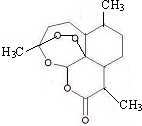 2011年9月,中国女科学家屠呦呦获得被誉为诺贝尔奖“风向标”的拉斯克奖,这是中国医学界迄今为止获得的世界级最高级大奖.她获奖理由是:“因为创制新型抗疟药--青蒿素和双氢蒿素,挽救了全球特别是发展中国家的数百万人的生命.”已知结构如右图所示,则下列说法正确的是( )
2011年9月,中国女科学家屠呦呦获得被誉为诺贝尔奖“风向标”的拉斯克奖,这是中国医学界迄今为止获得的世界级最高级大奖.她获奖理由是:“因为创制新型抗疟药--青蒿素和双氢蒿素,挽救了全球特别是发展中国家的数百万人的生命.”已知结构如右图所示,则下列说法正确的是( )| A、青蒿素与维生素C一样易溶于水 |
| B、青蒿素的晶体为分子晶体,其化学式为C16H20O5 |
| C、青蒿素不能与NaOH溶液反应 |
| D、青蒿素中含有过氧键,一定条件下有氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.8Q1+0.1Q2 |
| B、0.8Q1+0.2Q2 |
| C、0.8Q1+0.1Q3 |
| D、0.8Q1+0.2Q3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com