
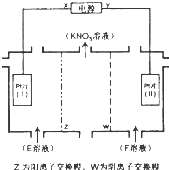
| A. | X为负极,F溶液NaNO3溶液 | |
| B. | 电解一段时间,往Pt片(I)附近滴入酚酞,溶液变红 | |
| C. | 电解总反应方程式为:2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑ | |
| D. | 理论上,当得到0.1molKNO3时,Pt片(Ⅱ)上生成标准状况下为1.12L的气体 |
分析 电解KCL和NaNO3溶液可以得到KNO3溶液,依据图中硝酸钾的出处可知结合Z为阳离子交换膜可知,E为氯化钾溶液,F为硝酸钠溶液,阴极为氯离子放电,阳极为氢离子放电,氯离子在Pt片(I)阳极发生氧化反应失去电子生成氯气,阴极氢离子在Pt片(Ⅱ)得到电子发生还原反应生成氢气,据此分析解答.
解答 解:电解KCL和NaNO3溶液可以得到KNO3溶液,依据图中硝酸钾的出处可知结合Z为阳离子交换膜可知,E为氯化钾溶液,F为硝酸钠溶液,阴极为氯离子放电,阳极为氢离子放电,氯离子在Pt片(I)阳极发生氧化反应失去电子生成氯气,阴极氢离子在Pt片(Ⅱ)得到电子发生还原反应生成氢气,
A.由上述分析可知E为氯化钾溶液,氯离子在Pt片(I)发生氧化反应,Pt片(I)为阳极,则X为正极,故A错误;
B.氯离子在Pt片(I)发生氧化反应生成氯气逸出,水电离产生的氢离子在Pt片(Ⅱ)得到电子发生还原反应生成氢气,则Pt片(Ⅱ)附近氢氧根离子浓度大于氢离子浓度,显碱性,加入酚酞溶液显红色,故B错误;
C.阴极为氯离子放电,阳极为氢离子放电,氯离子在Pt片(I)阳极发生氧化反应失去电子生成氯气,阴极氢离子在Pt片(Ⅱ)得到电子发生还原反应生成氢气,电解方程式为:H2O+2KCl$\frac{\underline{\;通电\;}}{\;}$2KOH+H2↑+Cl2↑,故C错误;
D.当得到0.1molKNO3时,则有0.1mol钾离子透过阳离子交换膜,则转移0.1mol电子,阳极电极反应式:
2Cl--2e-=Cl2↑,转移0.1mol电子生成0.05mol氯气,标况下体积为0.05mol×22.4L/mol=1.12L,
故D正确;
故选:D.
点评 本题考查了电解池工作原理,明确电解池工作原理、准确判断电解池电极及放电离子是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
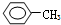
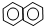
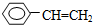
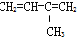
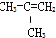
| A. | ④和⑥ | B. | ①、②和③ | C. | ⑤和⑦ | D. | ⑥和⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 表示的分子式为C6H14;名称是2-甲基戊烷.
表示的分子式为C6H14;名称是2-甲基戊烷.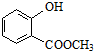 中含有的官能团的名称为羟基、酯基.
中含有的官能团的名称为羟基、酯基.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常见单质的沸点:W>Y>Z | |
| B. | W的氢化物为共价化合物 | |
| C. | 原子半径:Y<Z<W | |
| D. | X、Y可以形成既有极性键也有非极性键的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | C=0 | H-H | C-C | C-H | 0-H | C-0 |
| 键能/kJ•mol-1 | 803 | 436 | 332 | 409 | 463 | 326 |
| 成分 | 含量/(mg/L) | 成分 | 含量(mg/L) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3-; | 142 |
| SO42- | 2560 | Mg2+ | 1272 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
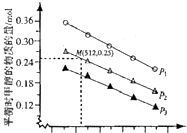
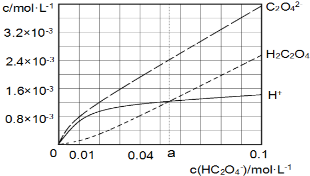 25℃时,往水中不断加入NaHC2O4固体,部分微粒浓度随c(HC2O4)的变化趋势如下图所示.下列说法正确的是( )
25℃时,往水中不断加入NaHC2O4固体,部分微粒浓度随c(HC2O4)的变化趋势如下图所示.下列说法正确的是( )| A. | 当c(HC2O4ˉ)=0.1mol•Lˉ1时,c(H+)>c(C2O42-)-c(H2C2O4) | |
| B. | 当c(HC2O4ˉ)>amol•Lˉ1时,c(H+)<c(H2C2O4),HC2O4ˉ的水解程度大于电离程度 | |
| C. | HC2O4ˉ?C2O42-+H+,Ka(HC2O4ˉ)=a | |
| D. | 将0.08mol•Lˉ1H2C2O4溶液与等浓度NaOH溶液等体积混合后(忽略体积变化),c(Na+)>c(HC2O4ˉ)>c(C2O42-)>c(H2C2O4)>c(H+)>c(OHˉ) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
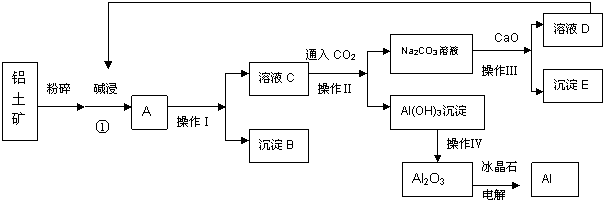
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 气化反应式 | 1gK | ||
| 700K | 900K | 1200K | |
| C(s)+H2O(g)=CO(g)+H2(g) | -2.64 | -0.39 | 1.58 |
| C(s)+2H2O(g)=CO2(g)+2H2(g) | -1.67 | -0.03 | 1.44 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按熔点由低到高排列I2、CO2、Hg、KCl、SiO2 | |
| B. | 在石英晶体中,每个硅原子和相邻的两个氧原子以共价键结合 | |
| C. | 有机物分子中碳原子成键方式和排列方式有多种以及同分异构现象的存在都是有机物种类繁多的原因 | |
| D. | 因为石墨是金刚石的同素异形体,所以二者空间结构相似,化学性质相似 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com