
【题目】太阳能的开发利用在新能源研究中占据重要地位,单晶硅太阳能电池片在加工时,一般掺杂微量的铜、钴、硼、镓、硒等。回答下列问题:
(1)基态二价铜离子的电子排布式为______,已知高温下Cu2O比CuO更稳定,试从核外电子排布角度解释______。
(2)铜的某种氧化物晶胞如图,该晶胞中阴离子的个数为___________。

(3)铜与(SCN)2反应生成Cu(SCN)2,1 mol(SCN)2中含有π键的数目为___________,HSCN结构有两种,硫氰酸(H-S-C≡N)的沸点低于异硫氰酸(H-N=C=S)的原因是___________。
(4)BF3能与NH3反应生成BF3·NH3。B与N之间形成配位键,氮原子提供_____,在BF3·NH3中B原子的杂化方式为_______。
(5)Co的一种氧化物CoO2晶体的层状结构如图所示(小球表示Co原子,大球表示O原子)。下列用粗线画出的重复结构单元不能描述CoO2的化学组成是(填字母代号)。________

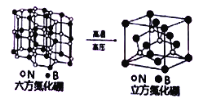
(6)六方氮化硼晶体结构与石墨晶体相似,层间相互作用力为___________。六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构、硬度与金刚石相似,其晶胞如图,晶胞边长为361.5pm,立方氮化硼的密度是___________g·cm-3(只列算式,NA为阿伏加德罗常数的值)。
【答案】1s22s22p63s23p63d9 或[Ar]3d9 亚铜离子价电子排布式为3d10,核外电子处于稳定的全充满状态 4 4NA或2.408×1024 异硫氰酸分子间可形成氢键,所以熔沸点较高 孤对电子 sp3 D 分子间作用力或范德华力 ![]()
【解析】
(1)Cu是29号元素,其原子核外有29个电子,Cu原子失去一个4s电子、一个3d电子生成二价铜离子,根据构造原理书写二价铜离子的电子排布式;原子轨道中电子处于半满、全满、全空时最稳定;
(2)利用均摊法可确定晶胞中氧离子的数目;
(3)(SCN)2结构式为N≡C-S-S-C≡N,据此判断π键数;
(4)硼元素具有缺电子性,NH3中的N上含有孤电子对;在BF3NH3中B原子价层电子对个数是4,根据价层电子对互斥理论确定B原子的杂化方式;
(5) CoO2的重复结构单元示意图中Co、O原子数目之比应为1:2,结合均摊法计算判断;
(6)六方氮化硼晶体结构与石墨晶体相似,石墨晶体层间为分子间作用力(或范德华力),层内为共价键,立方氮化硼的结构和硬度都与金刚石相似,二者结构相似,根据晶胞结构计算。
(1)Cu是29号元素,其原子核外有29个电子,Cu原子失去一个4s电子、一个3d电子生成二价铜离子,根据构造原理,二价铜离子的电子排布式为1s22s22p63s23p63d9;原子轨道中电子处于半满、全满、全空时最稳定,二价铜离子价电子排布式为3d9、亚铜离子价电子排布式为3d10,亚铜离子核外电子处于稳定的全充满状态,所以较稳定,故答案为:1s22s22p63s23p63d9或[Ar]3d9;亚铜离子价电子排布式为3d10,亚铜离子核外电子处于稳定的全充满状态;
(2)根据均摊法可知,晶胞中氧离子的数目为8×![]() +2×
+2×![]() +4×
+4×![]() +1=4,故答案为:4;
+1=4,故答案为:4;
(3)铜与类卤素(SCN)2反应生成Cu(SCN)2,(SCN)2分子中硫原子形成两个共用电子对、C原子形成四个共用电子对、N原子形成三个共用电子对,(SCN)2结构式为N≡C-S-S-C≡N,每个分子中含有4个π键,则1mol(SCN)2中含有π键的数目为4NA;能形成分子间氢键的物质熔沸点较高,异硫氰酸(H-N=C=S)分子间可形成氢键,而硫氰酸(H-S-C≡N)不能形成分子间氢键,所以异硫氰酸熔沸点高于硫氰酸,故答案为:4NA;异硫氰酸分子间可形成氢键,而硫氰酸不能,所以异硫氰酸熔沸点较高;
(4)硼元素具有缺电子性,其化合物可与具有孤电子对的分子或离子形成配合物,如BF3能与NH3反应生成BF3NH3.在BF3NH3中B原子价层电子对个数是4,根据价层电子对互斥理论,B原子的杂化方式为sp3,B与N之间形成配位键,N原子含有孤电子对,所以氮原子提供孤电子对,故答案为:孤电子对;sp3;
(5) CoO2的重复结构单元示意图中Co、O原子数目之比应为1∶2,由图像可知:A中Co、O原子数目之比为1∶4×![]() =1∶2,符合;B中Co、O原子数目之比为(1+4×
=1∶2,符合;B中Co、O原子数目之比为(1+4×![]() )∶4=1∶2,符合;C中Co、O原子数目之比为4×
)∶4=1∶2,符合;C中Co、O原子数目之比为4×![]() ∶4×
∶4×![]() =1∶2,符合;D中Co、O原子数目之比为1∶4×
=1∶2,符合;D中Co、O原子数目之比为1∶4×![]() =1∶1,不符合;故答案为:D;
=1∶1,不符合;故答案为:D;
(6)六方氮化硼晶体结构与石墨晶体相似,石墨晶体层间为分子间作用力(或范德华力),层内为共价键;立方氮化硼的结构和硬度都与金刚石相似,二者结构相似,根据晶胞结构,1个晶胞中含有4个N,8×![]() +6×
+6×![]() =4个B,不妨取1mol这样的晶胞,即有NA个这样的晶胞,1个晶胞的体积为V=a3cm3=(361.5×10-10)3cm3,则立方氮化硼的密度是ρ=
=4个B,不妨取1mol这样的晶胞,即有NA个这样的晶胞,1个晶胞的体积为V=a3cm3=(361.5×10-10)3cm3,则立方氮化硼的密度是ρ=![]() =
=![]() g/cm3,故答案为:分子间作用力(或范德华力);
g/cm3,故答案为:分子间作用力(或范德华力);![]() 。
。


科目:高中化学 来源: 题型:
【题目】下列物质的溶液在蒸发皿中加热蒸干并灼烧,可以得到该物质本身的是( )
①CuSO4;②KHCO3;③FeSO4;④NH4Cl;⑤MgSO4;⑥AlCl3 ;
A. ①③ B. ①⑤ C. ①③⑤ D. ①②⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化学反应的理论是一个经过简化的概念模型,合理简化的概念模型是研究化学反应原理的基础。反应速率的碰撞理论提出:能引发化学反应的碰撞称为有效碰撞。
(1)图I是HI分解反应中HI分子之间的几种碰撞示意图,其中属于有效碰撞的是________(填“a”“b”或“c”)。

(2)过渡态理论是在碰撞理论的基础上提出的:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。根据图Ⅱ写出相应的热化学方程式:_____________________________________________ 。
(3)过渡态理论认为,催化剂改变反应速率的原因是改变了活化能从而改变了反应的途径。请在图Ⅱ中画出该反应在其他条件不变,仅使用催化剂而使反应速率加快的能量变化示意图。________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 甲烷的标准燃烧热为-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式为CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B. 500 ℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
C. 常温下,反应C(s)+CO2(g)===2CO(g)不能自发进行,则该反应的ΔH>0
D. 同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,CH3COOH和NH3·H2O的电离常数均为1.8×10-5mol·L-1。向20mL浓度均为0.1mol·L-1 NaOH和NH3·H2O的混合液中滴加等物质的量浓度的CH3COOH溶液,所得混合液的电导率与加入CH3COOH溶液的体积(V)关系如图所示。下列说法错误的是
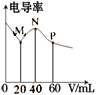
A. M点:c(Na+)>c(CH3COO-)>c(NH3·H2O)>c(NH4+)
B. 溶液呈中性的点处于N、P之间
C. 已知1g3≈0.5,P点的pH=5
D. P点:3[c(CH3 COO-)+ c(CH3COOH)]=2[ c(Na+)+c(NH4+)+c(NH3·H2O)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或装置正确的是
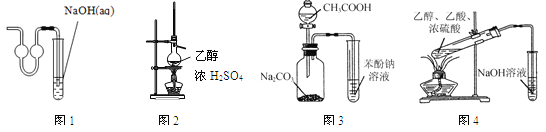
A. 利用图1所示装置吸收制取少量二氧化硫产生的尾气
B. 利用图2所示装置制取乙烯
C. 利用图3所示装置证明H2CO3酸性强于苯酚
D. 利用图4所示装置制备乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是生活生产中常见的物质,表中列出了它们的(主要)成分
编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
名称 | 酒精 | 醋酸 | 火碱 | 食盐 | 铜导线 | 亚硫酸酐 | 苏打 |
主要成分 | CH3CH2OH | CH3COOH | NaOH | NaCl | Cu | SO2 | Na2CO3 |
(1)请你对表中①~⑦的主要成分进行分类(填编号):
属于电解质的是_______________ ,属于非电解质的是____________________ 。
(2)过量②的水溶液与⑦反应的离子方程式 ________________________________。
(3)已知用金属钠制取氧化钠,可有多种方法:
①4Na + O2=2Na2O; ②4Na + CO2 =2Na2O + C;③2NaNO2 + 6Na =4Na2O + N2↑
在上述三种方法中,最好的是_________ ,原因是___________。
(4)某实验小组通过下列实验探究过氧化钠与水的反应:
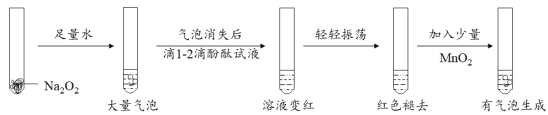
①用化学方程式解释使酚酞变红的原因 _______________________________;依据实验现象推测红色褪去的原因是___________________________________。
②加入MnO2反应的化学方程式为 ___________________________________ 。
(5)在实验室模拟侯氏制碱法制备碳酸钠:一定温度下,往一定量饱和NaCl溶液中通入氨气达到饱和后,再不断通入CO2,一段时间后,出现沉淀,过滤得到NaHCO3晶体。该过程的化学方程式为:____________
(6)在化学课上老师向NaOH溶液通入CO2后无明显现象,那我们如何通过实验证明CO2与NaOH发生了反应?某化学小组同学将过量的干冰放入氢氧化钠溶液中,利用数字化传感器测定溶液pH的变化,如图所示,请用化学方程式回答下列问题:

①BC段变化原因可能是 ___________________________________________________________ ;
②CD段变化原因可能是 ___________________________________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得:

(1) 贝诺酯分子式为
(2) 对乙酰氨基酚在空气易变质,原因是 。
(3) 用浓溴水区别乙酰水杨酸和对乙酰氨基酚,方案是否可行 (填“可行”或“不可行”)。
(4)写出乙酰水杨酸与足量氢氧化钠溶液反应的化学方程式 。
(5)实验室可通过两步反应,实现由乙酰水杨酸制备 ,请写出两步反应中依次所加试剂的化学式 、 。
,请写出两步反应中依次所加试剂的化学式 、 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeS、FeS2在酸性条件下都能与重铬酸钾(K2Cr2O7)溶液反应,还原产物为Cr3+,氧化产物都是Fe3+、SO42-。等物质的量FeS、FeS2完全反应时,消耗氧化剂的物质的量之比为
A.5:3B.9:17C.3:5D.3:4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com