
 实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:
实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:分析 (1)溴化钠与硫酸反应生成HBr,HBr与乙醇发生取代反应生成溴乙烷;利用量筒量取硫酸的体积;
(2)加热时烧瓶中发生取代反应生成溴乙烷和水;
(3)冰水混合物冷却有机混合物;溴乙烷的密度最大,在最下层;
(4)反应物中乙醇、HBr可能逸出;
(5)试管A中获得的有机物呈棕黄色,是由于浓硫酸具有强氧化性,将HBr氧化物Br2,产物为溴乙烷,混有单质溴,结合物质的性质及混合物分离方法解答.
解答 解:(1)实验室制取少量溴乙烷所用试剂是乙醇和溴化氢反应,二者在加热下发生取代反应生成溴乙烷;此实验量取溶液的体积要求精确度不是很高,可用量筒量取,
故答案为:乙醇;b;
(2)药品混合后在加热条件下发生NaBr+H2SO4═HBr+NaHSO4、HBr+CH3CH2OH$\stackrel{△}{→}$CH3CH2Br+H2O,生成溴乙烷的反应为HBr+CH3CH2OH$\stackrel{△}{→}$CH3CH2Br+H2O,
故答案为:HBr+CH3CH2OH$\stackrel{△}{→}$CH3CH2Br+H2O;
(3)收集装置所用导气管较长,可以起到冷却的作用,生成的溴乙烷和水互不相溶,并且溴乙烷的密度比水大,在冰水混合物的下层,
故答案为:冷却、液封溴乙烷;3;
(4)反应物中乙醇、HBr可能逸出,则试管A中除了产物和水之外,还可能存在HBr、CH3CH2OH,故答案为:HBr;CH3CH2OH;
(5)试管A中获得的有机物呈棕黄色,是由于浓硫酸具有强氧化性,将HBr氧化物Br2,产物为溴乙烷,混有单质溴,蒸馏不能完全除去杂质,并且操作麻烦,氢氧化钠溶液易使溴乙烷水解,四氯化碳会引入新的杂质,而亚硫酸钠和溴发生氧化还原反应生成HBr和硫酸钠,易与溴乙烷分离,所以d正确,
故答案为:d.
点评 本题考查有机物的制备实验,为高频考点,把握制备原理、实验装置的作用、实验技能为解答的关键,侧重分析与实验能力的考查,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol Na2O2中所含的阴离子数为0.2NA | |
| B. | 常温常压下,5.6 g N2和CO混合物中所含有的原子总数为0.4 NA | |
| C. | 标准状况下,2.24 L H2O中含有的氧原子数目为0.1 NA | |
| D. | Cu和足量的浓硫酸反应产生4.48 L气体时,转移的电子数为0.4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )
一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )| A. | 反应进行到5 s时,v(A)=v(B)=v(C)=v(D) | |
| B. | 反应进行到5 s时,B的平均反应速率为0.06mol/(L•s) | |
| C. | 反应进行到1 s时,v(A)=v(B) | |
| D. | 该反应的化学方程式为6A+2D?3B+4C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 邻二甲苯只有一种结构,能证明苯环中不存在碳碳单键和碳碳双键交替的结构 | |
| B. | 高聚物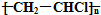 的单体可以通过乙烯和HCl加成制得 的单体可以通过乙烯和HCl加成制得 | |
| C. | (CH3)2CH-CH=CH-C(CH3)3与氢气加成后的产物用系统命名法命名为2,2,5-三甲基己烷 | |
| D. | 完全燃烧一定质量的冰醋酸、葡萄糖混合物(以任意质量比混合),生成CO2和H2O的物质的量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ①②④ | C. | ④⑤ | D. | ①② |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com