
【题目】反应2SO2(g)+O2(g)![]() 2SO3(g)在容积为2L的密闭容器中进行,初始时向容器里充入4molSO2和2mol18O2,在T1和T2温度下,SO3的物质的量与时间关系如图所示。请回答下列问题:
2SO3(g)在容积为2L的密闭容器中进行,初始时向容器里充入4molSO2和2mol18O2,在T1和T2温度下,SO3的物质的量与时间关系如图所示。请回答下列问题:
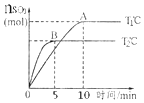
(1)反应后18O原子存在于哪些物质中___(填化学式)。
(2)上述反应的温度T1___ T2(填“>”“<”或“=”)。
(3)若温度T2时,5min后反应达到平衡,SO2的转化率为90%,则:
①平衡时体系内所含物质总的物质的量为___。
②平衡时SO3的浓度为___。
③下列说法不正确的是___。
A.如在该反应体系中加入适当的催化剂,可加快化学反应速率
B.其它条件相同时,该反应在T1时生成SO3的速率比T2时的小
C.该反应到达平衡时,体系内各组分的体积分数保持不变
D.若密闭容器中混合气体密度不变,则该反应达到化学平衡状态
【答案】SO2、O2、SO3 < 4.2mol 1.8molL-1 D
【解析】
(1)根据该反应为可逆反应分析判断;
(2)根据T2建立平衡需要的时间短,反应速率快分析判断;
(3)若温度T2时,5min后反应达到平衡,SO2的转化率为90%,转化的二氧化硫为4mol×90%=3.6mol,结合三段式分析计算,据此分析解答①和②;③A.使用催化剂加快反应速率;B.温度高,反应速率快;C.平衡时,各组分的含量、浓度均不变;D.根据2SO2(g)+O2(g)![]() 2SO3(g)的反应特点分析判断。
2SO3(g)的反应特点分析判断。
(1)该反应为可逆反应,含氧元素的物质均存在18O原子,则反应后18O原子存在于SO2、O2、SO3中,故答案为:SO2、O2、SO3;
(2)由图可知,T2的时间短,反应速率快,先建立平衡,则T2大,可知T1<T2,故答案为:<;
(3)若温度T2时,5min后反应达到平衡,SO2的转化率为90%,转化的二氧化硫为4mol×90%=3.6mol,则
2SO2(g)+O2(g)![]() 2SO3(g)
2SO3(g)
开始(mol) 4 2 0
转化(mol) 3.6 1.8 3.6
平衡(mol) 0.4 0.2 3.6
①平衡时物质的量为0.4mol+0.2mol+3.6mol=4.2mol,故答案为:4.2mol;
②平衡时SO3的浓度为![]() =1.8molL-1,故答案为:1.8molL-1;
=1.8molL-1,故答案为:1.8molL-1;
③A.使用催化剂加快反应速率,则在该反应体系中加入适当的催化剂,可加快化学反应速率,故A正确;B.温度高,反应速率快,则其它条件相同时,该反应在T1时生成SO3的速率比T2时的小,故B正确;C.平衡时,各组分的含量、浓度均不变,则反应到达平衡时,体系内各组分的体积分数保持不变,故C正确;D.2SO2(g)+O2(g)![]() 2SO3(g)在容积为2L的密闭容器中进行,气体的质量m、气体的体积V均不变,则密度始终不变,因此密度不变不能判定是否为平衡状态,故D错误;故选D。
2SO3(g)在容积为2L的密闭容器中进行,气体的质量m、气体的体积V均不变,则密度始终不变,因此密度不变不能判定是否为平衡状态,故D错误;故选D。


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】已知:![]() ,
,![]() 。298K时,
。298K时,![]() ,
,![]() ,
,![]() 。在CuCl、CuBr、CuI的饱和溶液中阳离子和阴离子浓度关系如图所示。下列说法正确的是
。在CuCl、CuBr、CuI的饱和溶液中阳离子和阴离子浓度关系如图所示。下列说法正确的是
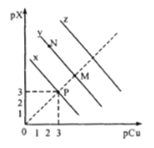
A.298K时,在CuCl的饱和溶液中加入少量NaCl,c(Cu+)和c(Cl-)都减小
B.图中x代表CuI曲线,且P点c(Cu+)=c(Cl-)
C.298K时增大M点的阴离子浓度,则y上的点向N点移动
D.298K时![]() 的平衡常数K的数量级为103或102
的平衡常数K的数量级为103或102
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、S和Cl元素的单质及化合物在工业生产中的有效利用备受关注。请回答下列问题:
(1)已知:Ⅰ.2SO2(g)+O2(g)+2H2O(l)=2H2SO4(aq)ΔH1;
Ⅱ.Cl2(g)+H2O(l)![]() HCl(aq)+HClO(aq)ΔH2;
HCl(aq)+HClO(aq)ΔH2;
Ⅲ.2HClO(aq)=2HCl(aq)+O2(g)ΔH3;
SO2(g)+Cl2(g)+2H2O(l)=2HCl(aq)+H2SO4(aq)
ΔH4=____________________(用含有ΔH1、ΔH2和ΔH3的代数式表示)。
(2)25℃时,H2SO3溶液中各含硫微粒的物质的量分数(δ)与溶液pH的变化关系如图甲所示。
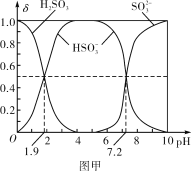
已知25℃时,NaHSO3的水溶液pH<7,用图中的数据通过计算解释原因_____________________________________________________。
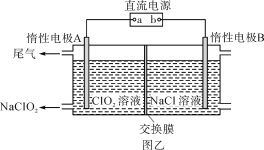
(3)NaClO2是一种绿色消毒剂和漂白剂,工业上采用电解法制备NaClO2的原理如图乙所示。
①交换膜应选用____________________(填“阳离子交换膜”或“阴离子交换膜”)。
②阳极的电极反应式为_____________________________________。
(4)一定温度下,向2L恒容密闭容器中通入2molCO和1molSO2,发生反应2CO(g)+SO2(g)![]() S(l)+2CO2(g)ΔH=-270kJ/mol,若反应进行到20min时达到平衡,测得CO2的体积分数为0.5,则前20min的反应速率v(CO)=______________,该温度下化学平衡常数K=____________(L·mol-1)
S(l)+2CO2(g)ΔH=-270kJ/mol,若反应进行到20min时达到平衡,测得CO2的体积分数为0.5,则前20min的反应速率v(CO)=______________,该温度下化学平衡常数K=____________(L·mol-1)
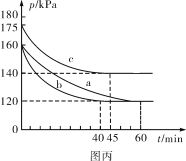
(5)在不同条件下,向2L恒容密闭容器中通入2molCO和1molSO2,反应体系总压强随时间的变化如图丙所示:
①图丙中三组实验从反应开始至达到平衡时,v(CO)最大的为__________(填字母序号)。
②与实验a相比,c组改变的实验条件可能是_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中加入等物质的量A、B,发生如下反应:2A(g)+2B(g)![]() 3C(s)+4D(g),平衡常数温度和压强的变化如表所示:
3C(s)+4D(g),平衡常数温度和压强的变化如表所示:
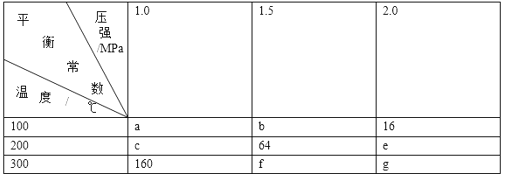
下列判断正确的是( )
A.g>f
B.△H<0
C.2.0MPa、300℃时,A的平衡转化率最小
D.1.5MPa、100℃时,B的平衡转化率为50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)![]() B(g) +C(g)在容积为1.0L的密闭容器中进行,A的初始浓度为0.050mol/L。温度T1和T2下A的浓度与时间关系如图所示。回答下列问题:
B(g) +C(g)在容积为1.0L的密闭容器中进行,A的初始浓度为0.050mol/L。温度T1和T2下A的浓度与时间关系如图所示。回答下列问题:
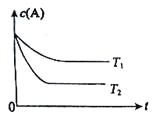
(1)上述反应的温度T1___ T2,平衡常数K(T1)___K(T2)。(填“大于”、“小于” 或“等于”)
(2)若温度T2时,5min后反应达到平衡,A的转化率为70%,则:
①平衡时体系总的物质的量为_______。
②反应的平衡常数K=______。
③反应在0~5min区间的平均反应速率v(A)=_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】痛灭定钠是一种吡咯乙酸类的非甾体抗炎药,其合成路线如下:

回答下列问题:
(1)化合物 A 中含氧官能团的名称是______。检验该官能团的化学反应方程式为______。
(2)化学反应①和④的反应类型分别为________和______。
(3)化学物B与等物质的量的Br2加成,最多生成_____种产物(不考虑顺反异构)。
(4)化合物 C 的结构简式为________。
(5)反应⑦的化学方程式为_______。
(6)芳香族化合物X的相对分子质量比A大14,写出遇FeCl3溶液显紫色且取代基仅位于苯环对位上化合物X的结构简式:______(不考虑立体异构)。
(7)根据该试题提供的相关信息,设计由化合物 ![]() 及必要的试剂制备有机化合物
及必要的试剂制备有机化合物![]() 的合成路线图___。
的合成路线图___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C(s)+H2O(g)![]() CO(g)+H2(g),在一可变容积的密闭容器中进行,下列条件改变对其反应速率几乎无影响的是( )
CO(g)+H2(g),在一可变容积的密闭容器中进行,下列条件改变对其反应速率几乎无影响的是( )
A. 体积不变,充入氮气使压强增大 B. 体积缩小一半
C. 压强不变,充入氮气使体积增大 D. 升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磁铁矿石的主要成分是四氧化三铁(化学式Fe3O4)根据它的化学式计算:
(1)四氧化三铁中铁元素和氧元素的质量比。__________________
(2)1 000 t四氧化三铁中含有铁元素的质量是多少吨。____________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com