
| A. | 氧化铜跟稀硝酸反应 | B. | 铜跟稀硝酸反应 | ||
| C. | 木炭和浓硝酸反应 | D. | 碳酸钙跟稀硝酸反应 |
分析 硝酸既表现酸性,又表现氧化性,说明反应过程中部分硝酸中元素化合价不变,部分硝酸中得电子化合价降低,根据元素化合价来分析解答.
解答 解:A.CuO3HNO3=Al(NO3)3+3H2O,该反应没有元素化合价变化,为非氧化还原反应,硝酸只体现酸性,故A错误;
B.铜跟稀硝酸反应,该反应中N元素的化合价降低,硝酸表现氧化性,生成硝酸铜体现酸性,所以硝酸既表现氧化性又表现酸性,故B正确;
C.木炭和HNO3反应生成二氧化碳、二氧化氮和水,发生C+4HNO3=CO2↑+2H2O+4NO2↑,硝酸只表现出强氧化性,故C错误;
D.碳酸钙跟稀硝酸反应,该反应没有元素化合价变化,为非氧化还原反应,硝酸只体现酸性,故D错误.
故选B.
点评 本题考查硝酸的性质,题目难度不大,本题注意硝酸酸性与氧化性的判断,注意根据物质的性质分析.


科目:高中化学 来源: 题型:解答题
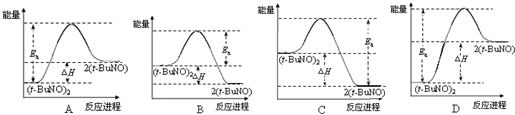
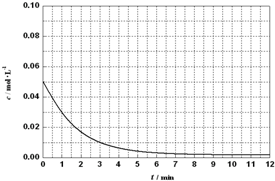
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
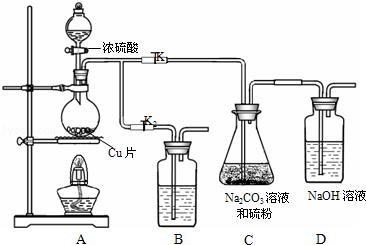
| 编 号 | 1 | 2 | 3 | 4 |
| 消耗Na2S2O3标准溶液的体积/mL | 18.02 | 17.98 | 18.00 | 20.03 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30g丙醇中存在的共价键总数为5NA | |
| B. | 密闭容器中2mol NO与1mol O2充分反应,转移的电子数为2NA | |
| C. | 常温常压下,22.4L氯气与足量镁粉充分反应,转移的电子总数为2NA | |
| D. | 2.8g乙烯和环丁烷(C4H8)的混合气体中含有的原子总数为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫常用来漂白纸浆 | B. | 漂粉精可用于游泳池的消毒 | ||
| C. | 明矾常用于水质消毒 | D. | 氧化铁常用作红色油漆和涂料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在中毒过程中血红蛋白被氧化 | B. | 解毒时血红蛋白被还原 | ||
| C. | 维生素C应具有还原性 | D. | 中毒时亚硝酸盐发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
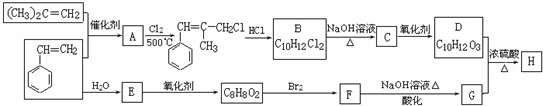
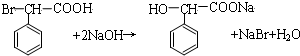 .
.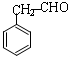 .
.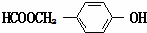 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
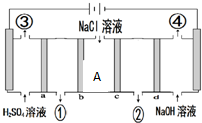
| A. | a和c为阳离子交换膜,b和d为阴离子交换膜 | |
| B. | ③与④两种气体体积比为1:1 | |
| C. | ①处生成的物质为氢氧化钠 | |
| D. | 当转移2mol e-时,A处减少离子数为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com