
2NO2(g)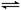 N2O4(g)
ΔH<0。现将NO2和N2O4 混合气体通入恒温密闭容器中,反应中物质浓度随时间的变化如图。下列说法正确的是
N2O4(g)
ΔH<0。现将NO2和N2O4 混合气体通入恒温密闭容器中,反应中物质浓度随时间的变化如图。下列说法正确的是
A.a点表示反应处于平衡状态
B.25 min末,若增大压强,化学平衡常数增大
C.25 min末,若升高温度,NO2的体积分数减小
D.10min内用N2O4表示的平均速率为0.02mol·L-1·min-1
D
【解析】
试题分析:a点物质的浓度还是在变化的,属于没有达到平衡状态,A不正确;平衡常数只与温度有关系,增大越强平衡常数不变,B不正确;正反应是放热反应,升高温度平衡向逆反应方向移动,所以NO2的体积分数增大,C不正确;根据方程式和图像可知,10min内N2O4浓度变化了0.6mol/L-0.2mol/L=0.2mol/L,所以用N2O4表示的平均速率为0.2mol/L ÷10min=0.02mol·L-1·min-1,D正确,答案选D。
考点:考查平衡状态、平衡常数的判断,外界条件对平衡状态的影响以及反应速率的计算
点评:化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值。平衡常数的大小可以衡量反应进行的程度,但需要注意的是平衡常数只与温度有关系和化学计量数有关系,在有关的判断、计算中需要注意到这一点。


科目:高中化学 来源:厦门双十中学2007届高三年级上学期半期考、化学试题 题型:058
(1)合成氨工业生产中所用的α—Fe催化剂的主要成分是FeO、Fe2O3.当催化剂中Fe2+与Fe3+的物质的量之比为1:2时,其催化剂活性最高.以Fe2O3为原料制备上述催化剂,可向其中加入适量炭粉,发生如下反应:
2Fe2O3+C=4FeO+CO2↑.为制得这种活性最高的催化剂,应向480gFe2O3粉末中加入炭粉的质量为________g.
(2)2gCu2S和CuS的混合物在酸性溶液中用400mL0.075mol/LKMnO4溶液处理,发生反应如下:
MnO4-+Cu2S+H+→Cu2++SO2++Mn2++H2O
MnO4-+CuS+H+→Cu2++SO2++Mn2++H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350mL0.1mol/L(NH4)2Fe(SO4)2溶液完全反应(KMnO4的还原产物为Mn2+).
则Cu2S和CuS的混合物中Cu2S的质量分数为________.
(3)已知:N2(g)+2O2(g)=2NO2(g);△H=+67.7kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g);△H=-534kJ/mol
N2O(1)=H2O(g);△H=+44kJ/mol
发射卫星用肼(即N2H4)的气体为原料,以NO2气体为氧化剂,两种物质反应生成氮气和液态水,试写出该反应的热化学方程式:________.
(4)用24.5%硫酸溶液(密度为1.20g/cm3)配制100ml0.20mol/L硫酸溶液时,要用到的玻璃仪器有:容量瓶、酸式滴定管、烧杯、胶头滴管和________.使用容量瓶时应先检查其是否________;用刚洗净的酸式滴定管量取24.5%硫酸溶液时,应先________,然后量取________mL24.5%硫酸溶液进行配制.
(5)现有足量铝屑、含1molH2SO4的浓硫酸、含1.5molNaOH的氢氧化钠溶液和水.①若用上述原料制取氢气,有以下两个方案:
方案一:用铝屑和氢氧化钠溶液制取氢气
方案二:用铝屑、浓硫酸和水制取氢气
你认为最好的方案是________其理由是:________.
②制取氢氧化铝可以有几种不同的方法.若用上述原料最多能制得________gAl(OH)3
查看答案和解析>>
科目:高中化学 来源:2010年福建省福州八中高二第二学期期末考试化学试题 题型:填空题
(14分)在80℃时,0.40mol的N2O4气体充入2L固定容积的密闭容器中发生如下反应:N2O4(g)  2NO2(g) ΔH>0 ,隔一段时间对该容器内的物质进行分析得到如下数据:
2NO2(g) ΔH>0 ,隔一段时间对该容器内的物质进行分析得到如下数据:
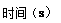  | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
| A.向混合气体中再通入N2O4 | B.保持容积不变,通入He |
| C.使用高效催化剂 | D.降低温度 |

查看答案和解析>>
科目:高中化学 来源:2015届广东省肇庆市高二上学期末考试化学试卷(解析版) 题型:选择题
下列有关热化学方程式的叙述,正确的是
A.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
B.由N2O 4(g)  2NO2(g)
△H= -56.9 kJ·mol-1,可知将1mol N2O4(g)置于密闭容器中充分反应后放出热量为56.9kJ
2NO2(g)
△H= -56.9 kJ·mol-1,可知将1mol N2O4(g)置于密闭容器中充分反应后放出热量为56.9kJ
C.由:H+(aq)+OH-(aq)= H2O(l) △H=-57.3kJ/mol,可知:含1mol CH3COOH的溶液与含1mol NaOH的溶液混合,放出热量为57.3 kJ
D.已知101kPa时,2C(s)+O2(g)===2CO(g) ΔH=-221kJ/mol,则1 mol碳完全燃烧放出的热量大于110.5kJ
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:填空题
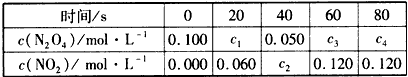
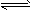 2NO2(g) 的平衡常数为_______,N2O4的转化率为______。
2NO2(g) 的平衡常数为_______,N2O4的转化率为______。查看答案和解析>>
科目:高中化学 来源:2011-2012学年福建省龙岩一中上学期高二期末考试化学试卷 题型:填空题
(14分)在80℃时,0.40mol的N2O4气体充入2L固定容积的密闭容器中发生如下反应:N2O4(g)  2NO2(g) ΔH>0 ,隔一段时间对该容器内的物质进行分析得到如下数据:
2NO2(g) ΔH>0 ,隔一段时间对该容器内的物质进行分析得到如下数据:
  | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
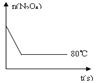
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com