
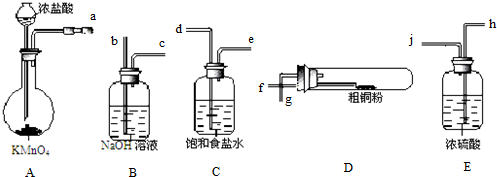

分析 I.(1)KMnO4与浓盐酸制取的Cl2含有HCl和H2O,用饱和食盐水除去HCl,用浓硫酸除去H2O,然后Cl2与Cu反应,最后用NaOH溶液吸收未反应的Cl2,防止污染空气;
(2)利用止水夹夹住导气管的橡皮管,从长颈漏斗中加水至漏斗内外形成液面高度差,一段时间内,液面高度差不变,说明气密性良好;
(3)D中发生反应有:氯气与Cu反应生成氯化铜,与Fe反应生成氯化铁;
(4)装置B吸收未反应的氯气,反应生成NaCl、NaClO,NaClO具有漂白性,钢铁制品表面生成红褐色沉淀、溶液会失去漂白、杀菌消毒功效,说明ClO-在正极上得电子,发生还原反应生产Cl-,由于为碱性条件,还生成OH-,
Ⅱ.粗铜含有Fe,制备的CuCl2中含有FeCl3,CuCl2和FeCl3均为强酸弱碱盐,能发生水解反应,水解产物均有HCl,加稀盐酸溶解,能抑制氯化铜、氯化铁水解,加入氢氧化钠溶液,消耗溶液中H+,调节pH使杂质Fe3+转化为沉淀而除去,溶液2含有CuCl2,通入一定量的SO2,生成沉淀CuCl,发生氧化还原反应,SO2为还原剂,被氧化为SO42?;
(3)由2Cu2++4I-=2CuI↓+I2、I2+2S2O32-=S4O42-+2I-,可得关系式2n(ClCl2)~I2~2n(S2O32-),据此计算200mL溶液中n(ClCl2),进而计算ClCl2的质量分数.
解答 解:I.(1)KMnO4与浓盐酸制取的Cl2含有HCl和H2O,用饱和食盐水除去HCl,用浓硫酸除去H2O,然后Cl2与Cu反应,最后用NaOH溶液吸收未反应的Cl2,防止污染空气,故按气流方向连接仪器接口顺序为a→d、e→j、h→f、g→b,
故答案为:d;e;j;h;f;g;b;
(2)检验A装置气密性方法为:利用止水夹夹住导气管的橡皮管,从长颈漏斗中加水至漏斗内外形成液面高度差,一段时间内,液面高度差不变,说明气密性良好,
故答案为:利用止水夹夹住导气管的橡皮管,从长颈漏斗中加水至漏斗内外形成液面高度差,一段时间内,液面高度差不变,说明气密性良好;
(3)D中发生反应有:氯气与Cu反应生成氯化铜,与Fe反应生成氯化铁,反应方程式为:Cu+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$CuCl2、2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3,
故答案为:Cu+Cl2$\frac{\underline{\;\;△\;\;}}{\;}$CuCl2、2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3;
(4)装置B吸收未反应的氯气,反应生成NaCl、NaClO,NaClO具有漂白性,钢铁制品表面生成红褐色沉淀、溶液会失去漂白、杀菌消毒功效,说明ClO-在正极上得电子,发生还原反应生产Cl-,由于为碱性条件,还生成OH-,该电化学腐蚀过程中正极反应式为:ClO-+2e-+H2O=Cl-+2OH-,
故答案为:ClO-+2e-+H2O=Cl-+2OH-;
Ⅱ.粗铜含有Fe,制备的CuCl2中含有FeCl3,CuCl2和FeCl3均为强酸弱碱盐,能发生水解反应,水解产物均有HCl,加稀盐酸溶解,能抑制氯化铜、氯化铁水解,加入氢氧化钠溶液,消耗溶液中H+,调节pH使杂质Fe3+转化为沉淀而除去,溶液2含有CuCl2,通入一定量的SO2,生成沉淀CuCl,发生氧化还原反应,SO2为还原剂,被氧化为SO42?,
(1)由上述分析可知,用稀盐酸溶解固体的原因是:抑制Cu2+、Fe3+水解,
故答案为:抑制Cu2+、Fe3+水解;
(2)溶液2含有CuCl2,通入一定量的SO2,生成沉淀CuCl,发生氧化还原反应,SO2为还原剂,被氧化为SO42?,反应离子方程式为:2Cu2++2Cl-+SO2+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl↓+4H++SO42-,
故答案为:2Cu2++2Cl-+SO2+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl↓+4H++SO42-;
(3)由2Cu2++4I-=2CuI↓+I2、I2+2S2O32-=S4O42-+2I-,可得关系式2n(ClCl2)~I2~2n(S2O32-),故200mL溶液中n(ClCl2)=n(S2O32-)=0.02L×0.2mol/L×$\frac{200mL}{2mL}$=0.4mol,则样品中m(ClCl2)=0.4mol×135g/mol=54g,则ClCl2的质量分数为$\frac{54g}{65g}$×100%=83.1%,
故答案为:83.1%.
点评 本题考查物质的制备实验方案、化学工艺流程,涉及对装置及操作的分析评价、气密性检验、电化学腐蚀、滴定计算等,侧重于基础知识的综合应用,难度中等.


 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 1:9 | B. | 1:49 | C. | 1:99 | D. | 以上都不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池是化学能转化成电能的装置 | |
| B. | 化学键断裂时吸收能量,形成时放出能量 | |
| C. | 化学反应中吸热反应时△H>0,放热反应时△H<0 | |
| D. | 标准状况下,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量为该物质的燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ①④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 2.3 | 4.0 | 7.6 |
| 完全沉淀pH | 4.1 | 5.2 | 9.6 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
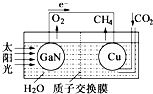 科学家用氮化镓材料与铜组装如图的人工光合系统,利用该装置成功地实现了以
科学家用氮化镓材料与铜组装如图的人工光合系统,利用该装置成功地实现了以| A. | 铜电极表面的电极反应式 CO2+8e-+8H+=CH4+2H2O | |
| B. | 为提高该人工光合系统的工作效率,可向装置中加入少量硫酸 | |
| C. | 该装置仅将化学能转变为电能 | |
| D. | 装置中的H+由左向右移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 发酵粉中主要含有氢氧化钠,能使焙制出的糕点疏松多孔 | |
| B. | 碘盐中的碘可以直接用淀粉检验 | |
| C. | 碳酸氢钠可用于治疗胃酸过多 | |
| D. | 硫酸氢钠属于盐类,其水溶液显中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向乙酸乙酯中加入足量的30%NaOH溶液,在加热的条件下观察酯层的消失 | |
| B. | 乙醇与浓硫酸混合,加热至140℃制取乙烯 | |
| C. | 向2mL的甲苯中加入3滴KMnO4酸性溶液,用力振荡,观察溶液颜色褪去 | |
| D. | 1 mol•L-1CuSO4溶液2 mL和0.5mol•L-1NaOH溶液2mL混合后加入40%的乙醛溶液0.5mL,加热煮沸观察砖红色沉淀的生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com