
| A. | 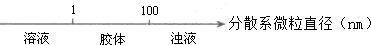 分散系的分类 | |
| B. | 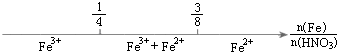 铁与稀硝酸反应后溶液中铁元素的存在形式 | |
| C. | 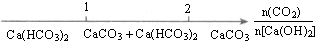 CO2通入澄清石灰水中反应的产物 | |
| D. | 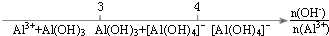 AlCl3溶液中滴加NaOH溶液后Al元素的存在形式 |
分析 A.依据分散系的本质区别是分散质微粒直径的大小判断;
B.依据铁和稀硝酸的定量反应分析判断;
C.依据二氧化碳与澄清的石灰水的定量反应分析判断;
D.依据铝离子与氢氧根离子的定量反应分析判断;
解答 解:A.1nm=10-7m,分散质微粒直径小于1nm形成的分散系为溶液,大于100nm形成的为浊液,分散质微粒直径在1nm~100nm时形成的分散系为胶体,故A正确;
B.反应的化学方程式:4HNO3(稀足)+Fe═Fe(NO3)3+NO↑+2H2O,3HNO3+8Fe═3Fe(NO3)2+2NO↑+4H2O,Fe与HNO3的物质的量之比为1:4时,恰好反应生成Fe(NO3)3,即Fe与HNO3的物质的量之比为≤$\frac{1}{4}$时反应得到Fe(NO3)3,Fe与HNO3的物质的量之比为3:8时,恰好反应生成Fe(NO3)2,即Fe与HNO3的物质的量之比为≥$\frac{3}{8}$时反应得到Fe(NO3)2,故B正确;
C.反应的化学方程式:Ca(OH)2+CO2═CaCO3↓+H2O;CaCO3+CO2+H2O═Ca(HCO3)2,CO2与Ca(OH)2的物质的量之比为1:1时,恰好反应生成CaCO3,即CO2与Ca(OH)2的物质的量之比为≤1时反应得到CaCO3,CO2与Ca(OH)2的物质的量之比为2:1时,恰好反应生成Ca(HCO3)2,即CO2与Ca(OH)2的物质的量之比为≥2时反应得到Ca(HCO3)2,故C错误.
D.OH-与Al3+的物质的量之比为3:1时,铝元素都以Al(OH)3的形式存在,即OH-与Al3+的物质的量之比为≤3时铝元素都以Al(OH)3和Al3+的形式存在,OH-与Al3+的物质的量之比为4:1时,铝元素都以Al(OH)4-的形式存在,即OH-与Al3+的物质的量之比为≥4时铝元素都以Al(OH)4-的形式存在,故D正确;
故选C.
点评 本题考查了常见的用数轴法表示化学知识,注意所表示的意义和定量关系分析判断,题目难度中等,掌握化学方程式的书写和定量关系计算是解题的关键.


科目:高中化学 来源: 题型:填空题


 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 . H2O2
. H2O2 NH4Cl
NH4Cl
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y元素最高价氧化物对应水化物的化学式可表示为H2YO3 | |
| B. | Z和M组成的化合物与盐酸反应可以生成两种盐 | |
| C. | X、Y、Z元素的气态氢化物中,Y的沸点最高 | |
| D. | 四种元素简单离子的半径由大到小依次为Y>X>Z>M |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稳定性:HCl>H2S>H2O | B. | 熔、沸点HF>HCl>HBr | ||
| C. | 熔、沸点KCl<MgO<MCl2 | D. | 熔、沸点CH4<SiH4<GeH4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com