
��8��) ��֪��25��ʱ��
H2SO3 Ka1=1.5��10-2 Ka2=1.0��10-7
H2CO3 Ka1=4.4��10-7 Ka2=4.7��10-11
HNO2 Ka=5.1��10-4
HClO Ka=3.0��10-8
����NaClO��Һ��Ũ��ԼΪ3 mol/L��
��1�������£�0.1 mol/L NaClO��Һ��pH 0.1 mol/L Na2SO3��Һ��pH����ѡ����ڡ�����С�ڡ����ڡ�)��Ũ�Ⱦ�Ϊ0.1 mol/L ��Na2SO3��Na2CO3�Ļ����Һ�У�SO32�C��CO32�C��HSO3�C��HCO3�C Ũ�ȴӴ�С��˳��Ϊ ��
��2���������ӷ�Ӧ������ǣ�_____________��
A��2HCO3��+SO2= SO32��+2CO2+ H2O
B��ClO��+CO2+ H2O= HClO+ HCO3��
C��ClO��+SO2+ H2O= HClO+ HSO3��
D��2ClO��+SO2+ H2O= 2HClO+ SO32��
��3��ij����Һ����Ч�ɷ�ΪNaClO��������һ������NaOH�ȣ���������������ʵ�ķ���ʽ�в��������ǣ�_________��
A��������Һ����NaOH��Һ����Cl2�Ʊ���Cl2 +2OH��=Cl��+ ClO��+ H2O
B��������Һ��pHԼΪ12��ClO��+ H2O HClO+ OH��
HClO+ OH��
C��������Һ�����飨��Ҫ�ɷ�ΪHCl)���ã�����Cl2��2H��+ Cl��+ ClO��= Cl2 ��+ H2O
D��������Һ�Ӱ״�����HClO������ǿƯ�����ã� H++ ClO��= HClO
��4��25��ʱ��0.1 mol��������ֱ���1 L0.l mol��L-1��NaOH��Һ��Ӧ���γɵ���ҺpH�ɴ�С��˳��Ϊ��__________����A��B��C��D��ʾ)��
A��NO2 B��SO2 C��SO3 D��CO2
 ��ְٷְټ�����Ԫ��ĩ���Ծ�ϵ�д�
��ְٷְټ�����Ԫ��ĩ���Ծ�ϵ�д� Сѧ��ĩ���Ծ�ϵ�д�
Сѧ��ĩ���Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�����ʡ�����и�һ9���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
ʵ��������Ҫ����2mol/L��NaCl��Һ950mL������ʱӦѡ�õ�����ƿ�Ĺ��ͳ�ȡNaCl�����ֱ���
A��950mL��111.2g B��500mL��117g
C��1000mL��117g D��1000mL��111.2g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�����ʡ������һ���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
������Ʒ�ںϳɡ�ҽҩ��Ⱦ�ϵȹ�ҵ���й㷺��;����ṹʽ��ͼ��ʾ������ȩˮ��Һ�백ˮ����������Ƶ�������Ʒ����ԭ����ȫ��Ӧ����������Ʒ�����ȩ�백�����ʵ���֮��Ϊ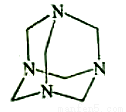
A��1��1 B��2��3 C��3��2 D��2��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�����ʡ����8���¿�����ѧ���ף���ѧ�Ծ��������棩 ���ͣ������
��ϼʯ��(��Ҫ�ɷ�ΪNa2O��K2O��Al2O3��SiO2)��̼���ơ�̼��غ��������Ĺ����������£���֪��NaHCO3��Һ��pHԼΪ8��9��Na2CO3��Һ��pHԼΪ11��12��
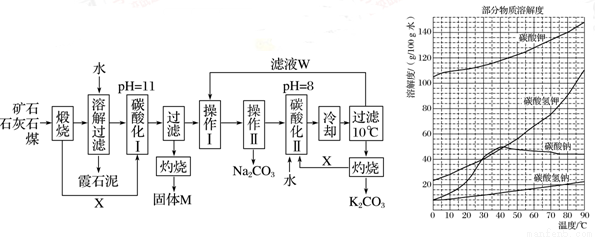
�ܽ���˹����������Һ�к��ơ��غ����Ŀ��������࣬�ƺ����������������ϼʯ���С��������ʵ��ܽ������ͼ����������ش��������⣺
��1������M�Ļ�ѧʽ��________��X������________��
��2��ʵ���ҽ������ղ���ʱʢ�Ź������ʵ�ʵ��������________����ҺW����Ҫ���е�������________��
��3��̼�ữ���з�����Ҫ��Ӧ�����ӷ���ʽ��____________��
��4����������________(��д����)����������________(ѡ����)��
a�����ȹ��� b����ȴ���� c������ d������
��5��̼�ữ�����pH��8��Ŀ����______����ƷK2CO3������ܺ��е�������__________(д��ѧʽ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�����ʡ����8���¿�����ѧ���ף���ѧ�Ծ��������棩 ���ͣ�ѡ����
������ʵ�鷽�����ԴӺ��������������ȡ���п��������Ե���Ȼ���

����˵���������
A�����裨1����Ҫ����װ�� B�����裨2����Ҫ�õ���Һ©��
C�����裨3����Ҫ�õ����� D�����裨4����Ҫ����װ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�����ʡ������¼��8���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪������Ľṹ��ͼ��ʾ�����ڿ������������ȷ����
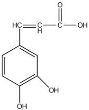
A������ʽΪC9H5O4
B��1mol������������5mol���������ӳɷ�Ӧ
C������ˮ���ܷ���ȡ����Ӧ�����ܷ����ӳɷ�Ӧ
D������Na2CO3��Һ��Ӧ����������NaHCO3��Һ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�����ʡ������ĸ����ϵ�һ����ͳ����ѧ�Ծ��������棩 ���ͣ�ѡ����
N2O5��һ����������������һ���¶��¿ɷ������·�Ӧ��2N2O5(g�� 4NO2(g)��O2(g�� ��H��0��һ���¶�ʱ�����ܱ�������ͨ��N2O5������ʵ�����ݼ��±���
4NO2(g)��O2(g�� ��H��0��һ���¶�ʱ�����ܱ�������ͨ��N2O5������ʵ�����ݼ��±���
ʱ��/s | 0 | 500 | 1000 | 1500 |
c(N2O5)/mol/L | 0.50 | 0.35 | 0.25 | 0.25 |
����˵���д������
A��500 sʱO2��Ũ��Ϊ0.075 mol/L
B��ƽ��������¶ȣ�����Ӧ������������С
C��ƽ���Ҫʹƽ�ⳣ�����ı�������������¶�
D��1000 sʱ�������������Сһ�룬���´ﵽƽ��ʱ0.25 mol/L��c(N2O5)��0.50 mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016��ӱ�ʡ����9���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
���������ᷴӦ��������NaOH��Һ��Ӧ����
��Na2SiO3 ��Al(OH)3 ��SiO2 ��Al2O3 ��NaHCO3
A���٢ڢ� B���ڢܢ� C���ڢۢ� D��ȫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016������ʡ������ѧ�ڵ�һ���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��һ�������£����������ʵ�����ϵ���з�Ӧ�����Ӧ�����ӷ���ʽ��ѧ����ʽ��д��ȷ����
A��n(Cl2)��n(Fe)��5��4 5Cl2��4Fe 2FeCl2��2FeCl3
2FeCl2��2FeCl3
B��n(Cl2)��n(FeBr2)��1��1 Fe2����2Br����Cl2=Fe3����Br2��2Cl��
C��n(MnO4��)��n(H2O2)��2��3 2MnO4����3H2O2��6H��=2Mn2����4O2����6H2O
D��n(Fe)��n[HNO3(ϡ)]��1��3 4Fe��12H����3NO3��===3Fe2����Fe3����3NO����6H2O
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com