
| A. | 新制氯水呈淡黄绿色(HCl) | |
| B. | 新制氯水中滴加AgNO3溶液生成白色沉淀(Cl-) | |
| C. | 向NaHCO3溶液中加入新制氯水,有无色气泡(H+) | |
| D. | 将有色布条放入新制氯水中,有色布条褪色(HClO) |
分析 A、氯水中含有大量的氯气分子,导致氯水显黄绿色;
B、氯水中的氯离子能与硝酸银发生复分解反应;
C、氯水中有酸,酸电离生成的H+能与NaHCO3固体反应;
D、次氯酸具有强氧化性,能氧化有色布条;
解答 解:A、因氯水中含有大量的氯气分子,导致氯水显黄绿色,和氯气有关,故A错误;
B、因氯水中的盐酸电离生成Cl-,氯离子能与硝酸银发生复分解反应生成氯化银白色沉淀,和氯离子有关,故B正确;
C、因氯水中有盐酸和次氯酸,均可电离生成H+,H+能与NaHCO3固体反应生成二氧化碳气体,则会有无色气泡出现,与新制氯水中的氢离子有关系,故C正确;
D、次氯酸具有强氧化性,能氧化有色布条,故D正确;
故选A.
点评 本题考查氯水的成分及氯气的化学性质、次氯酸的化学性质,明确氯水的成分是解答本题的关键,并熟悉各微粒的性质来解答即可.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | ①④⑥⑦⑧ | B. | ③④⑤⑥⑦ | C. | ①④⑤⑥⑦⑧ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
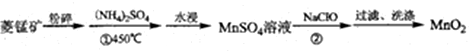
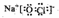 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应在高温下才能自发进行 | |
| B. | 再加入一定量CO2,则n(CH3OH)/n(CO2)减小 | |
| C. | 温度升高,反应的平衡常数K增大 | |
| D. | 当CO2和H2转化率相等时,该反应达到化学平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ② | C. | ③ | D. | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔点:SiO2<CO2 | B. | 沸点:H2O<H2S | ||
| C. | 晶格能:CaCl<NaCl | D. | 热稳定性:HF<HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 | 0.1MPa | 0.5MPa | 1MPa | 1.5MPa |
| 400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9988 |
| 500℃ | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
| 600℃ | 0.8520 | 0.8897 | 0.9276 | 0.9468 |
| 沸腾炉温度/℃ | 600 | 620 | 640 | 660 |
| 炉渣中CuSO4的质量分数/% | 9.3 | 9.2 | 9.0 | 8.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>Y | B. | 最高价含氧酸酸性:W>R | ||
| C. | 气态氢化物稳定性:Y>R | D. | 简单离子半径:Y>Z |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com