
【题目】在一定温度下的定容密闭容器中,发生反应:A(s)+2B(g)![]() C(g)+D(g),当下列物理量不再变化时,不能表明反应已达平衡的是
C(g)+D(g),当下列物理量不再变化时,不能表明反应已达平衡的是
A. 固体A的质量B. 混合气体的密度
C. 混合气体的平均相对分子质量D. 混合气体的压强
【答案】D
【解析】
根据化学平衡状态的特征解答,当反应达到平衡状态时,正、逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态。
A.固体A的质量不再发生变化,说明正逆反应速率相等,反应达平衡状态,A正确;
B.反应前后气体质量发生变化,若混合气体的密度不变,说明气体的质量不变,反应达平衡状态,B正确;
C.混合气体的平均相对分子质量不变,说明气体的质量不变,反应达平衡状态,C正确;
D.该反应是反应前后气体分子数不变的反应,两边气体计量数相等,容器的容积不变,则混合气体的物质的量一直不变,不能据此判断反应为平衡状态,D错误;
故合理选项是D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】以下是25 ℃时几种难溶电解质的溶解度:
难溶电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
溶解度/g | 9×10-4 | 1.7×10-6 | 1.5×10-4 | 3.0×10-9 |
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些杂质离子。例如:
①为除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,过滤结晶即可;
②为除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤结晶即可;
③为除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=a,过滤结晶即可。
请回答下列问题:
(1)上述三种除杂方案都能够达到很好的效果,Fe3+、Fe2+都被转化为__________________(填化学式)而除去。
(2)①中加入的试剂应该选择__________为宜,其原因是______________________________。
(3)②中除去Fe3+所发生的总反应的离子方程式为____________________________________。
(4)已知Fe(OH)3的Ksp=1×10-35 ;化学上通常认为残留在溶液中离子浓度小等于1×10-5mol/L时,沉淀完全。方案③中a最小值为________________。
(5)下列与方案③相关的叙述中,正确的是___________________________(填字母)。
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质,不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=a可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=a的溶液中
E.在pH>a的溶液中Fe3+一定不能大量存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是298K时,N2与H2反应过程中能量变化的曲线图,下列叙述不正确的是
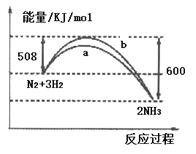
A. 在温度、体积一定的条件下,通入1mol N2和3mol H2 反应后放出的热量为92kJ
B. a曲线是加入催化剂时的能量变化曲线
C. 加入催化剂,也不能提高N2的转化率
D. 该反应的热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H=﹣92 kJ/mol
2NH3(g) △H=﹣92 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】直接排放含SO2的烟气会形成酸雨,危害环境。工业上常采用催化还原法和碱吸收法处理SO2气体。

(1)如图所示:1mol CH4完全燃烧生成气态水的能量变化和1mol S(g)燃烧的能量变化。在催化剂作用下,CH4可以还原SO2生成单质S(g)、H2O(g)和CO2,写出该反应的热化学方程式________________________________________________________。
(2)焦炭催化还原二氧化硫的化学方程式为2C(s)+2SO2(g) ![]() S2(g)+2CO2(g)。一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的生成速率与S2(g)的生成速率随温度变 化的关系如图所示:
S2(g)+2CO2(g)。一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的生成速率与S2(g)的生成速率随温度变 化的关系如图所示:
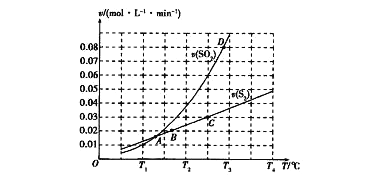
①A、B、C、D四点对应的状态中,达到平衡状态的有_____________(填字母)。
②该反应的△H_____0(填“>”“<”或“=”)。
③下列措施能够增大SO2平衡转化率的是______________。
A.降低温度 B.增加C的量 C.减小容器体积 D.添加高效催化剂
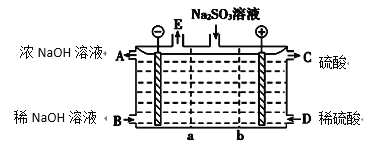
(3)某研究小组用NaOH溶液吸收尾气中的二氧化硫,将得到的Na2SO3溶液进行电解,其中阴、阳膜组合电解装置如图所示,电极材料为石墨。
①a表示________(填“阴”或“阳”)离子交换膜。A~E分别代表生产中的原料或产品,其中A为浓氢氧化钠溶液,C为硫酸溶液,E表示________(写化学式)。
②电解过程中,阳极的电极反应式为_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E四种短周期元素,它们的原子序数依次增大。其中A与C、B与E分别是同主族元素。已知B、E两元素间可形成EB2和EB3两种化合物,两者相对分子质量相差16。又知A、C两元素原子序数之和是B、E两元素原子序数之和的![]() , D的单质是一种常见的半导体材料。请回答下列问题:
, D的单质是一种常见的半导体材料。请回答下列问题:
(1)D位于元素周期表的位置是___________________。
(2)写出由B、C两种元素形成的原子个数比为1:1的化合物的电子式:________,该化合物中所含化学键的类型有_________________。
(3)A2B与A2E的沸点:A2B______A2E(填“高于”或“低于”),其原因是:___________________________。
(4)由A、B、C、E四种元素形成的物质X,与盐酸反应能够生成具有刺激性气味的气体。写出X与盐酸反应的离子方程式:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温下,物质的量之比为2∶1的SO2和O2的混合气体在容积为2 L的恒容密闭容器中发生反应:2SO2(g)+O2(g)![]() 2SO3(g)(正反应为放热反应),n(SO2)随时间变化关系如下表:
2SO3(g)(正反应为放热反应),n(SO2)随时间变化关系如下表:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
n(SO2)/mol | 0.20 | 0.16 | 0.13 | 0.11 | 0.08 | 0.08 |
下列说法正确的是
A. 反应开始到平衡过程中气体的平均相对分子质量不变
B. 若要提高SO2的转化率,可鼓入过量空气
C. 从反应开始到达到平衡,用SO3表示的平均反应速率为0.01 mol/(L·min)
D. 容器内达到平衡状态时的压强与起始时的压强之比为5∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)[化学——选修5:有机化学基础]
近来有报道,碘代化合物E与化合物H在Cr-Ni催化下可以发生偶联反应,合成一种多官能团的化合物Y,其合成路线如下:

已知:![]()
回答下列问题:
(1)A的化学名称是________________。
(2)B为单氯代烃,由B生成C的化学方程式为________________。
(3)由A生成B、G生成H的反应类型分别是________________、________________。
(4)D的结构简式为________________。
(5)Y中含氧官能团的名称为________________。
(6)E与F在Cr-Ni催化下也可以发生偶联反应,产物的结构简式为________________。
(7)X与D互为同分异构体,且具有完全相同官能团。X的核磁共振氢谱显示三种不同化学环境的氢,其峰面积之比为3∶3∶2。写出3种符合上述条件的X的结构简式________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com