
【题目】现用传感技术测定喷泉实验中的压强变化来认识喷泉实验的原理。下列说法不正确的是
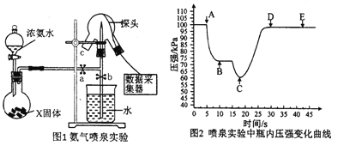
A.制取氨气时烧瓶中的固体常用CaO或NaOH
B.关闭a,将单孔塞(插有吸入水的胶头滴管)塞紧瓶口c,打开b,完成喷泉实验,电脑绘制三颈瓶内压强变化曲线如图2,则C点时喷泉最剧烈
C.将湿润的蓝色石蕊试纸置于三颈瓶口,试纸变红,说明NH3已经集满
D.该实验可以用来说明氨气在水中的溶解度很大
科目:高中化学 来源: 题型:
【题目】某温度时,在5 L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。请通过计算回答下列问题:
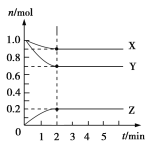
(1)反应开始至2 min,Y的平均反应速率________。
(2)分析有关数据,写出X、Y、Z的反应方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气、氨气和二氧化硫三种气体均是重要的化工原料且都会对环境造成污染,某课外活动小组拟探究三者的部分性质。
Ⅰ.利用如图装置探究干燥的氯气与氨气之间的反应。
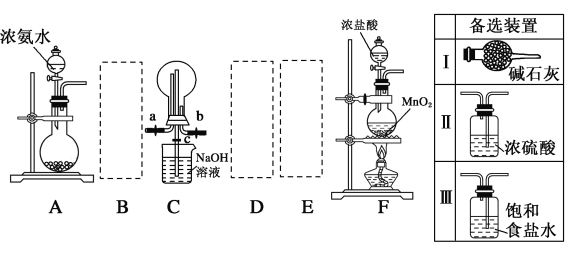
(1)请从备选装置中选择适当的装置连入虚线框中,组成一套完整的探究干燥的氯气与氨气之间的反应的装置,用备选装置序号填空:B___、D__、E__。
(2)装置A中的烧瓶内固体宜选用__(选填以下选项的字母)。
A 烧碱 B 生石灰
C 二氧化硅 D 五氧化二磷
(3)实验时先打开a、c活塞,关闭b活塞,向烧瓶中先通入氨气,然后关闭c活塞,打开b活塞,再向烧瓶中通入氯气,实验中装置C的烧瓶内出现浓厚的白烟并在容器内壁凝结,试推测发生反应的化学方程式为8NH3+3Cl2=6NH4Cl+N2。实验完毕后观察到C烧瓶内还有黄绿色气体,简述如何处理才能不污染环境____________________。
Ⅱ.探究干燥的氯气和SO2的反应:SO2(g)+Cl2(g) SO2Cl2(l) ΔH=-97.3 kJ·mol-1。硫酰氯(SO2Cl2)通常条件下为无色液体,熔点为-54.1 ℃,沸点为69.1 ℃,在潮湿空气中“发烟”,100 ℃以上开始分解,生成二氧化硫和氯气,长期放置也会发生分解。该小组同学用A装置制取SO2,分液漏斗中加入浓硫酸,圆底烧瓶中加入Na2SO3固体,B选择备选装置Ⅱ,将C装置用如图所示的装置甲替换,其余的装置不变来完成探究实验。
SO2Cl2(l) ΔH=-97.3 kJ·mol-1。硫酰氯(SO2Cl2)通常条件下为无色液体,熔点为-54.1 ℃,沸点为69.1 ℃,在潮湿空气中“发烟”,100 ℃以上开始分解,生成二氧化硫和氯气,长期放置也会发生分解。该小组同学用A装置制取SO2,分液漏斗中加入浓硫酸,圆底烧瓶中加入Na2SO3固体,B选择备选装置Ⅱ,将C装置用如图所示的装置甲替换,其余的装置不变来完成探究实验。
(4)装置甲中仪器G的名称为____________,甲中活性炭的作用是____。
(5)如果去掉装置B、D,则在甲的三颈烧瓶中可能发生反应的化学方程式为__________。
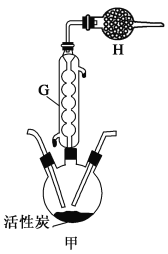
(6)为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有____(填序号)。
A 先通冷凝水,再通气
B 控制气流速率,宜慢不宜快
C 若三颈烧瓶发烫,可适当降温
D 加热三颈烧瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题:
(1)已知:N2、O2分子中化学键的键能分别是946 kJ·mol-1、497 kJ·mol-1。N2(g)+O2(g)=2NO(g) ΔH=+180.0 kJ·mol-1。则相同条件下破坏1 mol NO中的化学键需要吸收的能量为________kJ。
(2)25℃时,pH=5的CH3COOH溶液中,由水电离出的氢离子浓度c(H+)=________mol·L-1;往溶液中加入少量NaOH固体,则溶液中![]() ___________(填“增大”、“减小”或“不变”),写出表示该混合溶液中所有离子浓度之间的一个等式:________。
___________(填“增大”、“减小”或“不变”),写出表示该混合溶液中所有离子浓度之间的一个等式:________。
(3)25℃时,向某Na2CO3溶液中加入稀盐酸,其中含碳元素的各种微粒物质的量分数(φ)随溶液pH变化的部分情况如图所示。
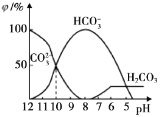
①在同一溶液中,H2CO3、HCO3-、CO32-____________(填“能”或“不能”)大量共存。
②当pH=7时,溶液中含碳元素的微粒主要为___________。
③反应的CO32-+H2O![]() HCO3-+OH-的平衡常数Kh=___________。
HCO3-+OH-的平衡常数Kh=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是 ( )
A.氯水中有平衡:Cl2+H2O![]() HCl+HClO,当加入AgNO3溶液后,溶液颜色变浅
HCl+HClO,当加入AgNO3溶液后,溶液颜色变浅
B.对CO(g)+NO2(g)![]() CO2(g)+NO(g),平衡体系增大压强可使颜色变深
CO2(g)+NO(g),平衡体系增大压强可使颜色变深
C.对2NO2(g)![]() N2O4(g), 升高温度平衡体系颜色变深
N2O4(g), 升高温度平衡体系颜色变深
D.SO2催化氧化成SO3的反应,往往加入过量的空气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,pH=11的氨水和NaOH溶液分别加水稀释100倍,溶液的pH随溶液体积变化的曲线如图所示。根据图像判断错误的是( )
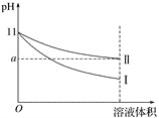
A. a值一定大于9
B. Ⅰ为NaOH溶液稀释时溶液的pH变化曲线
C. 完全中和稀释相同倍数后的两溶液,消耗相同浓度的稀H2SO4的体积V(NaOH)<V(氨水)
D. 稀释后氨水中水的电离程度比NaOH溶液中水的电离程度大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国研究人员研制出一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水,其主要过程如下图所示。

已知:几种物质中化学键的键能如下表所示。
化学键 | H2O中H—O键 | O2中O=O 键 | H2中H—H键 | H2O2中O—O键 | H2O2中O—H键 |
键能kJ/mol | 463 | 496 | 436 | 138 | 463 |
若反应过程中分解了2 mol水,则下列说法不正确的是
A. 总反应为2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
B. 过程I吸收了926 kJ能量
C. 过程II放出了574 kJ能量
D. 过程Ⅲ属于放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、Q、R 是周期表中前 36 号元素,核电荷数依次增大,其中 X、Y、Z、 W 都是元素周期表中短周期元素。X 为非金属元素,且 X 原子的核外成对电子数是未成对电子数的 2 倍,Z 的次外层电子数是最外层电子数的![]() ,W 原子的 s 电子与 p 电子数相等,Q 是前四周期中电负性最小的元素,R 的原子序数为 29。 回答下列问题:
,W 原子的 s 电子与 p 电子数相等,Q 是前四周期中电负性最小的元素,R 的原子序数为 29。 回答下列问题:
(1)X的最高价氧化物对应的水化物分子中,中心原子采取______________杂化。
(2)化合物 XZ 与 Y 的单质分子互为______________,1mol XZ 中含有π键的数目为______________。
(3)W 的稳定离子核外有______________种运动状态的电子。W元素的第一电离能比其同周期 相邻元素的第一电离能高,其原因是:_____。
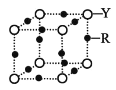
(4)Q 的晶体结构如图所示,则在单位晶胞中 Q 原子的个数为______________,晶体的配位数是______________。

(5)R元素的基态原子的核外电子排布式为________;Y 与 R 形成某 种化合物的晶胞结构如图所示,已知该晶体的密度为ρg·cm-3,阿伏加德罗常数的数值为 NA,则该晶体中 R 原子和 Y 原子之间的最短距离为______________cm。(只写计算式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国重晶石(含BaSO490%以上)资源丰富,其中贵州省重晶石储量占全国总储量的三分之一。我省某工厂以重晶石为原料,生产“电子陶瓷工业支柱”——钛酸钡(BaTiO3)的工艺流程如下:

查阅资料可知:
①常温下: Ksp(BaSO4)=1.0×10-10,Ksp(BaCO3)=2.5×10-9
②TiC14在常温下是无色液体,遇水容易发生水解:TiCl4+2H2O=TiO2+4HCl。
③草酸氧钛钡的化学式为:BaTiO(C2O4)2·4H2O。
请回答下列问题:
(1)工业上用饱和Na2CO3溶液处理重晶石(假设杂质不与Na2CO3溶液作用),待达到平衡后,移走上层清液,重复多次操作,将BaSO4转化为易溶于酸的BaCO3,该过程用离子方程式可表示为___________,此反应的平衡常数K=____ (填写计算结果)。若不考虑CO32- 的水解,则至少需要使用_____mol/L 的Na2CO3溶液浸泡重晶石才能实现该转化过程。
(2)酸浸时所发生反应的离子方程式为___________________________________。
(3)配制TiCl4溶液时通常将TiCl4固体溶于浓盐酸再加水稀释,其目的是_____________________。
(4)可循环使用的物质X 是_________(填化学式),设计实验方案验证草酸氧钛钡晶体是否洗涤干净:_____________________________________________________________。
(5)煅烧草酸氧钛钡晶体得到BaTiO3的同时,高温下生成的气体产物有CO、__________和_________(填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com