
【题目】下列关于苯的说法正确的是
A.常温下苯是无色无味的液体B.苯的密度比水小
C.苯存在单、双键交替结构D.苯不能发生取代反应
 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
【题目】工业上利用铁的氧化物在高温条件下循环裂解水制氢气的流程如下图所示。
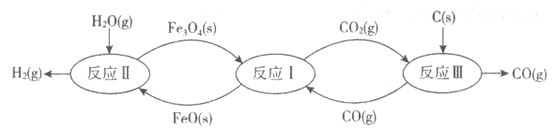
(1)反应I的化学方程式为:Fe3O4(s)+CO(g)![]() 3FeO(s)+CO2(g),反应Ⅱ的化学方程式为_________,对比反应I、Ⅱ,铁的氧化物在循环裂解水制氢气过程中的作用是_________。用化学方程式表示反应I、Ⅱ、Ⅲ的总结果:_________。
3FeO(s)+CO2(g),反应Ⅱ的化学方程式为_________,对比反应I、Ⅱ,铁的氧化物在循环裂解水制氢气过程中的作用是_________。用化学方程式表示反应I、Ⅱ、Ⅲ的总结果:_________。
(2)反应III为:CO2(g)+C(s)![]() 2CO(g)
2CO(g) ![]() H>0。为了提高达平衡后CO的产量,理论上可以采取的合理措施有_________(任写一条措施)。
H>0。为了提高达平衡后CO的产量,理论上可以采取的合理措施有_________(任写一条措施)。
(3)上述流程中铁的氧化物可用来制备含有Fe3+的刻蚀液,用刻蚀液刻蚀铜板时,可观察到溶液颜色逐渐变蓝,该反应的离子方程式为_________。刻蚀液使用一段时间后会失效,先加酸,再加入过氧化氢溶液,可实现刻蚀液中Fe3+的再生,该反应的离子方程式为_________。
(4)上述流程中碳的氧化物可用来制备碳酰肼[CO(NHNH2)2,其中碳元素为+4价]。加热条件下,碳酰肼能将锅炉内表面锈蚀后的氧化铁转化为结构紧密的四氧化三铁保护层,并生成氮气、水和二氧化碳。该反应的化学方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将15.2 g 铜和镁组成的混合物加入250 mL4.0 mol L-1的稀硝酸中,固体完全溶解,生成的气体只有NO。向所得溶液中加入1.0 L NaOH溶液,此时金属离子恰好沉淀完全,沉淀质量为25.4 g,下列说法不正确的是
A. 原固体混合物中,Cu和Mg的物质的量之比为2:1
B. 氢氧化钠溶液的浓度为0.8 mol·L-1
C. 固体溶解后的溶液中硝酸的物质的量为0.1mol
D. 生成的NO气体在标况下的体积为4.48L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,反应N2(g)+3H2(g) ![]() 2NH3(g)达到化学平衡状态的标志是
2NH3(g)达到化学平衡状态的标志是
A. N2、H2和NH3的质量分数不再改变
B. c(N2)∶c(H2)∶c(NH3)=1∶3∶2
C. 断裂1 mol N≡N键的同时,形成6 mol N—H键
D. N2与H2的物质的量之和是NH3的物质的量的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g)![]() 2SO3(g) △H<O,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是
2SO3(g) △H<O,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是

A. 图I研究的是t0时刻增大O2的浓度对反应速率的影响
B. 图II研究的是t0时刻增大压强后对反应速率的影响
C. 图III研究的是催化剂对化学平衡的影响,且甲的催化效率比乙高
D. 图III研究的是温度对化学平衡的影晌.且乙的温度较高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实现“节能减排”和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),下图表示该反应过程中能量(单位为kJ·mol-1)的变化如图,关于该反应的下列说法中,正确的是
CH3OH(g)+H2O(g),下图表示该反应过程中能量(单位为kJ·mol-1)的变化如图,关于该反应的下列说法中,正确的是
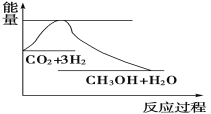
A. ΔH>0,ΔS>0 B. ΔH>0,ΔS<0 C. ΔH<0,ΔS>0 D. ΔH<0,ΔS<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,关闭活塞,向甲、乙两刚性密闭容器中分别充入1 mol A、2 mol B,此时甲、乙的容积均为2 L(连通管体积忽略不计)。在T℃时,两容器中均发生下述反应:A(g)+2B(g)![]() 2C(g)+3D(g) △H < 0。达平衡时,乙的体积为2.6 L,下列说法正确的是
2C(g)+3D(g) △H < 0。达平衡时,乙的体积为2.6 L,下列说法正确的是
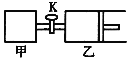
A. 甲中反应的平衡常数小于乙
B. 若打开活塞K,达平衡时乙容器的体积为3.2 L
C. 当乙中A与B的体积分数之比为1:2时,反应达到平衡状态
D. 平衡时甲容器中A的物质的量小于0.55 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各图是表示相应变化的能量关系图,其中正确的是( )
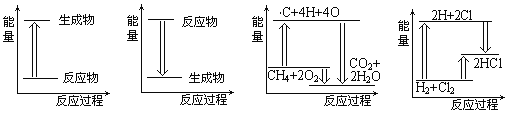
A. 锌与稀硫酸的反应 B. 植物的光合作用 C. 天然气燃烧 D. H2与Cl2反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com