
【题目】常温下,有KOH和Ca(OH)2的混合溶液,测得其pH=13。取此溶液300 mL,向其中通入CO2,通入CO2的体积(V)和生成沉淀的物质的量(n)的关系如图所示,图中V1为224 mL(标准状况),则图中V2、V3的数值(单位为mL)分别是( )
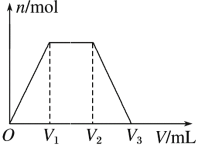
A.336、672 B.448、672
C.1120、1176 D.296、352
【答案】B
【解析】
试题解析:由图分析O→V1, CO2与Ca(OH)2生成CaCO3反应,V1为224 Ml,n(CO2)=0.01mol; n(Ca(OH)2) =0.01 mol; n(KOH)=0.1×0.3-0.01×2=0.01 mol; KOH消耗二氧化碳反应生成碳酸氢钾溶液;V2-V1 =0.01 × 22.4;V2 = V1 + 0.224 = 0.224+0.224=0.448L=448mL;V2—V3过程为CaCO3与CO2、H2O生成Ca(HCO3)2的反应。因此消耗n(CO2)= n(Ca(OH)2)=0.01 mol; V3- V2=0.01×22.4;V3= V2+0.224=0.448+0.224=0.672L=672Ml; 答案B正确;
考点:二氧化碳与混合碱液反应的变化规律。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】Fe2+、Fe3+与O![]() 、CN-、F-有机分子等形成的化合物具有广泛的应用。
、CN-、F-有机分子等形成的化合物具有广泛的应用。
(1)C、N、O原子的第一电离能由大到小的顺序是___________________________。
(2)Fe2+基态核外电子排布式为__________________________。
(3)乙酰基二茂铁是常用汽油抗震剂,其结构如图1所示。
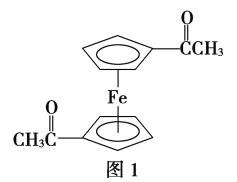
此物质中碳原子的杂化方式是______________________。
(4)配合物K3Fe(CN)6可用于电子传感器的制作。与配体互为等电子体的一种分子的化学式为________________。已知(CN)2是直线型分子,并具有对称性,则(CN)2中π键和σ键的个数比为___________________________。
(5)F-不仅可与Fe3+形成[FeF6]3-,还可以与Mg2+、K+形成一种立方晶系的离子晶体,此晶体应用于激光领域,结构如图2所示。
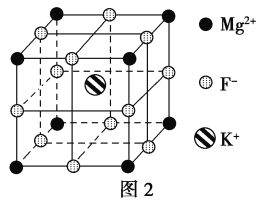
该晶体的化学式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Fe2+、Al3+、Na+。某同学为了确认其成分,取部分试液,设计并完成了如下实验:
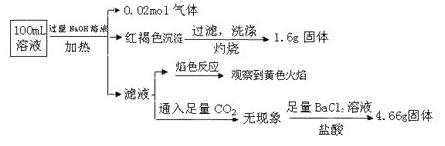
下列说法正确的是( )
A. 原溶液中c(Fe3+)=0.2 molL-1
B. 溶液中至少有4种离子存在,其中Cl-一定存在,且c(Cl-)≥0.2 mol·L-1
C. SO42ˉ、NH4+、Na+一定存在,CO32ˉ一定不存在
D. 要确定原溶液中是否含有Fe2+,其操作为:取少量原溶液于试管中,加入适量氯水,无现象,再加KSCN溶液,溶液成血红色,则含有Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体粉末样品中可能含有SiO2、Fe2O3、CaO、CuO、MgO、Na2O和炭粉等成分,为确认其中的组分,某同学设计并完成了如下实验:
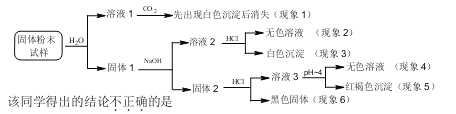
A.从现象1和3可推断样品中有CaO,没有Na2O
B.从现象3可推断样品中有SiO2
C.从现象4和5可推断样品中有Fe2O3和MgO
D.从现象4和6可推断样品中有炭粉,无CuO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据表中信息,判断以下叙述正确的是 ( )
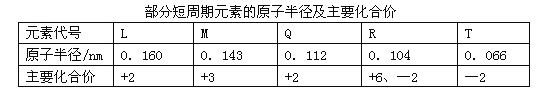
A. 氢化物的稳定性为H2T<H2R B. 单质与稀盐酸反应的速率为L>Q
C. L与M的最高价氧化物的水化物的碱性L<M D. L2+ 与R2- 的核外电子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在配制一定物质的量浓度的盐酸时,下列错误操作可使所配制溶液浓度偏高的是
A.溶解搅拌时有液体飞溅
B.用量筒量取浓盐酸时仰视读数
C.定容时仰视容量瓶瓶颈刻度线
D.定容摇匀后见液面下降,再加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,有甲、乙两个密闭容器,甲容器的体积为1L,乙容器的体积为2L,分别向甲、乙两容器中加入6molA和3molB,发生反应如下:3A(g)+bB(g)![]() 3C(g)+2D(g)ΔH<0;4min时甲容器内的反应恰好达到平衡,
3C(g)+2D(g)ΔH<0;4min时甲容器内的反应恰好达到平衡,
A的浓度为2.4mol/L,B的浓度为1.8mol/L;tmin时乙容器内的反应达平衡,
B的浓度为0.8mol/L.根据题给信息回答下列问题:
(1)甲容器中反应的平均速率v(B)=______________。
(2)乙容器中反应达到平衡时所需时间t__________4 min(填“大于”、“小于”或“等于”)。
(3)若要使甲、乙容器中B的平衡浓度相等,可以采取的措施是______________。
A.保持温度不变,增大甲容器的体积至2 L
B.保持容器体积不变,使甲容器升高温度
C.保持容器体积和温度都不变,向甲中加入一定量的A气体
D.保持容器体积和温度都不变,向甲中加入一定量的B气体
(4)该温度下,向体积为1L的密闭容器中通入A、B、C、D气体物质的量分别为3mol、1mol、3mol、2mol,此时反应________________(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”))
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对“改变反应条件,导致化学反应速率改变”的原因描述不正确的是
A.增大反应物的浓度,活化分子百分数增加,反应速率加快
B.增大气体反应体系的压强,单位体积中活化分子数增多,气体反应速率加快
C.升高反应的温度,活化分子百分数增加,有效碰撞的几率提高,反应速率增大
D.催化剂通过改变反应路径,使反应所需的活化能降低,反应速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学电池在通讯,交通及日常生活中有着广泛的应用。
(1)目前常用的镍(Ni)镉(Cd)电池,其电池总反应可以表示为Cd+2NiO(OH)+2H2O![]() 2Ni(OH)2+Cd(OH)2。已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法中正确的是( )
2Ni(OH)2+Cd(OH)2。已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法中正确的是( )
①以上反应是可逆反应 ②以上反应不是可逆反应
③充电时化学能转变为电能 ④放电时化学能转变为电能
A.①③ B.②④
C.①④ D.②③
(2)废弃的镍镉电池已成为重要的环境污染物,有资料表明一节废镍镉电池可以使一平方米面积的耕地失去使用价值,在酸性土壤中这种污染尤为严重。这是因为___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com