
【题目】现有几组物质的熔点数据如表所示。
A组 | B组 | C组 | D组 |
金刚石:3550℃ |
|
|
|
硅晶体:1410℃ |
|
|
|
硼晶体:2300℃ |
|
|
|
二氧化硅:1723℃ |
|
|
|
请回答下列问题:
(1)A组属于______晶体,其熔化时克服的微粒间的作用力是______。
(2)B组晶体共同的物理性质是______(填序号)。
A.有金属光泽 B.有导电性 C.有导热性 D.有延展性
(3)C组中酸性最弱的是______,最不稳定的是______。
(4)D组晶体可能具有的性质是______(填序号)。
A.硬度小 B.水溶液能导电 C.固体能导电 D.熔融状态下能导电
【答案】原子 共价键 ABCD ![]()
![]() BD
BD
【解析】
A组物质的熔点都比较高;B组晶体都是金属晶体,具有金属通性;HF、HCl、HBr、HI的酸性逐渐增强;F、Cl、Br、I的非金属性逐渐减弱,据此判断分子的稳定性;D组晶体都是离子晶体,结合离子晶体的性质分析解答。
(1)A组物质的熔点都比较高,属于原子晶体,原子晶体的构成微粒为原子,微粒间作用力为共价键,熔化时需要克服共价键,故答案为:原子;共价键;
(2)B组晶体都是金属晶体,具有金属通性,所以具有导电性、导热性、延展性等物理性质,故选ABCD;
(3)HF、HCl、HBr、HI的酸性逐渐增强,酸性最弱的是HF;F、Cl、Br、I的非金属性逐渐减弱,HF、HCl、HBr、HI的稳定性逐渐减弱,最不稳定的是HI,故答案为:HF;HI;
(4)D组晶体都是离子晶体,离子晶体熔融态能导电,可溶性离子晶体在水溶液中能导电,固态时没有自由移动的离子,所以固体不导电,故答案为:BD。


科目:高中化学 来源: 题型:
【题目】某校实验小组的同学利用下图所示实验装置探究氨与氧化铜的反应(图中夹持、固定装置均略去)。
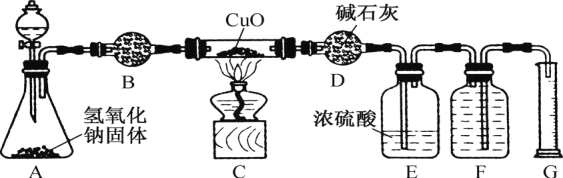
(1)按图设计组装好仪器,先__________________,再装入药品。
(2)A中分液漏斗内应装_________________ ,B中固体试剂为__________________。
(3)打开分液漏斗活塞,加入试剂,点燃C处的酒精灯,一段时间后,观察到C中氧化铜全部转化成光亮的红色固体,F中集气瓶内收集到一种无色气态单质。写出装置C中反应的化学方程式:______。
(4)E中浓硫酸的作用是__________________。
(5)用平衡移动原理解释A中产生气体的原因__________________________ 。(用相关的离子方程式和必要的文字描述)
(6)已知Cu2O也是红色的。下表为实验前后C装置的质量,通过计算可知反应后的产物中______ (填“有”、“无”或“无法确定”)Cu2O。
空玻璃管 | 实验前(样品+玻璃管) | 实验后(样品+玻璃管) |
59.60 g | 65.60g | 64.64g |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的化学方程式:
(1)苯制备溴苯___________________。
(2)制备TNT_____________________。
(3)2溴丙烷消去反应______________。
(4)实验室制乙烯__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中科院深圳先进技术研究院成功研发了一种高效低成本储能电池——“铝一石墨”双离子电池,电池总反应为Al+xC+Li++PF6 -![]() AlLi+Cx PF6下列有关该电池的说法正确的是
AlLi+Cx PF6下列有关该电池的说法正确的是
A. 放电时,PF6-向正极移动
B. 放电时,负极反应为A1-3e-====Al3+
C. 充电时,两个电极增加的质量相等
D. 充电时,阳极反应为xC+PF6--e-==CxPF6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体![]() 的化学式为
的化学式为![]() ,它的所有原子的最外层都符合相应稀有气体原子的最外电子层结构,则下列有关说法不正确的是
,它的所有原子的最外层都符合相应稀有气体原子的最外电子层结构,则下列有关说法不正确的是
A.![]() 中既有离子键又有共价键B.
中既有离子键又有共价键B.![]() 的熔、沸点高于
的熔、沸点高于![]()
C.![]() 中含有
中含有![]() 键D.
键D.![]() 形成的晶体是离子晶体
形成的晶体是离子晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常状况下,![]() 、
、![]() 和
和![]() 是三种气态单质。
是三种气态单质。![]() 的组成元素是第3周期原子半径最小的元素(稀有气体元素除外);
的组成元素是第3周期原子半径最小的元素(稀有气体元素除外);![]() 和
和![]() 均由元素
均由元素![]() 组成,
组成,![]() 能氧化
能氧化![]() ,反应的离子方程式为
,反应的离子方程式为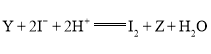 。
。
(1)写出物质的分子式:![]() ______,
______,![]() ______,
______,![]() ______。
______。
(2)![]() 与
与![]() 的关系是______(填序号)。
的关系是______(填序号)。
a.互为同位素 b.属于同一物质
c.互为同素异形体 d.互为同分异构体
(3)导致大气中![]() 减少的主要物质是______。
减少的主要物质是______。
(4)将![]() 和二氧化硫分别通入品红溶液中,都能使品红溶液褪色。利用褪色的溶液区别二者的实验方法是________________________。
和二氧化硫分别通入品红溶液中,都能使品红溶液褪色。利用褪色的溶液区别二者的实验方法是________________________。
(5)举例说明![]() 的氧化性比硫单质的氧化性强:________________________(用化学方程式表示)。
的氧化性比硫单质的氧化性强:________________________(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一容积可变的密闭容器里,反应 2A(g)B(g)+2C(g)达到平衡时,A、B 和 C 的物质的量分别为 4mol、2mol、4mol。在保持温度和压强不变的条件下,下列说法正确的是( )
A.充入 1mol 稀有气体氦(He),平衡将不发生移动
B.充入A、B、C 各 1mol,平衡将向正反应方向移动
C.将 A、B、C 各物质的物质的量都减半,C 的百分含量不变
D.加入正催化剂,正逆反应速率均加快,平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用工业废气 CO2 或 CO 和 H2 在一定条件下可制备燃料甲醇。
Ⅰ.利用工业废气 CO 合成甲醇,其能量变化示意图如下:
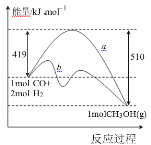
(1)图中曲线 a 到曲线 b 的措施是_______。该反应 ΔS________0(填“>”或“<”)
(2)一定条件下,在 2 L 密闭容器中充入 1 mol CO 和 2 mol H2,10 min 后达到平衡,放出热量 45.5kJ,则 10 min 内 H2 的转化率为_____;该温度下反应的平衡常数 K=_____;达到平衡后,再向容器中充入 CO、H2、CH3OH 各 1 mol,则此时 υ正_____υ逆 (填“>”“<”或“=”)
(3)下列措施可以提高甲醇产率的是_____。
a.压缩容器体积
b.将 CH3OH (g)从体系中分离
c.恒容条件下充入He,使体系总压强增大
d.恒压条件下再充入 10mol CO 和 20mol H2
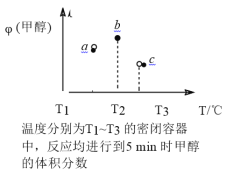
(4)现有容积均为 1L 的 a、b、c 三个密闭容器,向其中分别充入 1molCO 和 2molH2 的混合气体,控制温度,进行反应,测得相关数据的关系如图所示。b 中甲醇体积分数大于 a 中的原因是_______达到平衡时,a、b、c 中 CO 的转化率大小关系为_______。
Ⅱ.用工业废气中的 CO2制取甲醇和水蒸气
(5)一定条件下,往2L恒容密闭容器中充入1mol CO2和3mol H2,在不同催化剂作用下发生反应 I、反应II与反应III,相同时间内CO2的转化率随温度变化如图所示:
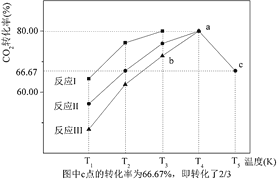
①催化剂效果最佳的反应是_____(填“反应 I”,“反应 II”,“反应 III”)。
②b 点υ正_____υ逆(填 “>”, “<”, “=”)。
③若此反应在 a 点时已达平衡状态,a 点的转化率比 c 点高的原因是_____。
④c点时该反应的平衡常数K=_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下用惰性电极电解200 mLNaCl、CuSO4的混合溶液,所得气体的体积随时间变化如图所示,根据图中信息回答下列问题。(气体体积已换算成标准状况下的体积,且忽略气体在水中的溶解和溶液体积的变化)。
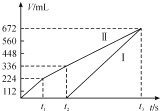
(1)曲线___(填“Ⅰ”或“Ⅱ”)表示阳极产生气体的变化。
(2)NaCl的物质的量浓度为___,CuSO4的物质的量浓度为___。
(3)t2时所得溶液的pH为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com