
| A. | 该反应是氧化还原反应 | |
| B. | 该反应的△H<0 | |
| C. | 生成新物质的化学式为 Fe2S3 | |
| D. | 生成新物质的总能量低于反应物铁粉和硫粉的总能量 |
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:选择题
| A. | 10℃时0.1 mol/L Na2S2O3和0.1 mol/L H2SO4各 5 mL | |
| B. | 20℃时0.1 mol/L Na2S2O3和0.1 mol/L H2SO4各 5 mL | |
| C. | 10℃时0.1 mol/L Na2S2O3和0.1 mol/L H2SO4各5 mL,加水10mL | |
| D. | 20℃时0.2mol/L Na2S2O3和0.1 mol/LH2SO4各5 mL,加水10 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 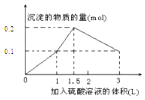 | B. | 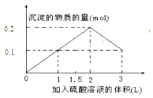 | ||
| C. | 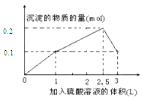 | D. | 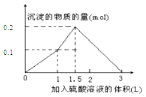 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 用标签所示浓盐酸配制250mL 0.4mol/L的稀盐酸,并进行有关实验.请回答:
用标签所示浓盐酸配制250mL 0.4mol/L的稀盐酸,并进行有关实验.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
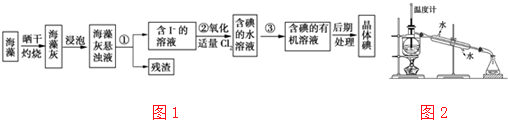
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验编号 | 操作 | 现象及结论 |
| a | 加入2mL蒸馏水,再加入10mL 5mol/L Na2S2O8溶液,振荡 | 红色固体逐渐溶解,先慢后快. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com