
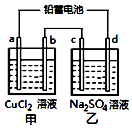
 用铅蓄电池电解甲、乙电解池中的溶液.已知铅蓄电池的总反应为:Pb+PbO2+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是( )
用铅蓄电池电解甲、乙电解池中的溶液.已知铅蓄电池的总反应为:Pb+PbO2+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是( )| A. | d极为阴极 | |
| B. | 放电时铅蓄电池负极的电极反应式为:PbO2+4H++SO42-+4e-=PbSO4+2H2O | |
| C. | 若四个电极材料均为石墨,当析出6.4gCu时,消耗H2SO40.2mol | |
| D. | 甲池中阳离子向b极移动 |
分析 原电池放电时,正极发生还原反应,电极反应是PbO2+4H++SO42--2e-=2H2O+PbSO4,负极为Pb+SO42--2e-=PbSO4,在充电时,阴极发生的反应是PbSO4+2e-=Pb+SO42-,阳极反应为PbSO4-2e-+2H2O=PbO2+SO42-+4H+;
电解一段时间后,c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,则c是阴极、d是阳极,a是阴极、b是阳极,据此分析解答.
解答 解:原电池放电时,正极发生还原反应,电极反应是PbO2+4H++SO42--2e-=2H2O+PbSO4,负极为Pb+SO42--2e-=PbSO4,在充电时,阴极发生的反应是PbSO4+2e-=Pb+SO42-,阳极反应为PbSO4-2e-+2H2O=PbO2+SO42-+4H+;
电解一段时间后,c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,则c是阴极、d是阳极,a是阴极、b是阳极,
A.通过以上分析知,c是阴极、d是阳极,故A错误;
B.放电时,正极反应式为PbO2+4H++SO42--2e-=2H2O+PbSO4,负极为Pb+SO42--2e-=PbSO4,故B错误;
C.电解析出6.4gCu,其物质的量是6.4g÷64g/mol=0.1mol,转移0.2mol电子,根据Pb~2e-~2H2SO4,消耗硫酸0.2mol,故C正确;
D.甲池中阳离子移向阴极a极,故D错误;
故选C.
点评 本题考查原电池和电解池原理,明确离子放电顺序是解本题关键,难点是电极反应式的书写,注意C中采用转移电子守恒进行计算,题目难度中等.


 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镀锡的铁皮,破损后铁皮反而易被腐蚀 | |
| B. | 纯铁比生铁更易被腐蚀 | |
| C. | 金属的电化腐蚀比化学腐蚀普遍 | |
| D. | 金属腐蚀的本质是M-ne-=Mn+而被损耗 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe(OH)3溶于HI溶液中:Fe(OH)3+3H+═Fe3++3H2O | |
| B. | 磁性氧化铁溶于稀盐酸:Fe3O4+8H+═Fe3++2Fe2++4H2O | |
| C. | NaAlO2溶液中通入过量CO2:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- | |
| D. | 酸性高锰酸钾溶液和硫酸亚铁溶液反应:MnO4-+3Fe2++4H+═MnO2↓+3Fe3++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Fe3+ | Co2+ | Co3+ | Al3+ | |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com