
| A. | Si和B | B. | N和Be | C. | S和Mg | D. | C和Al |
分析 两种主族元素X和Y,X元素的单质通常是黄色固体,则X为S元素;S原子M电子层上的电子数为6,它的M层电子数是Y原子M电子层上的电子数的3倍,则Y原子的M电子层的电子数为2,所以Y核外有12个电子,据此判断X、Y元素.
解答 解:两种主族元素X和Y,X元素的单质通常是黄色固体,则X为S元素;S原子M电子层上的电子数为6,它的M层电子数是Y原子M电子层上的电子数的3倍,则Y原子的M电子层的电子数为2,所以Y的电子排布为2、8、2,即Y核外有12个电子,则为Mg元素,故C正确;
故选C.
点评 本题考查了元素的推断,主要考查根据核外电子排布规律推断元素,难度不大,理解核外电子排布规律并能灵活运用.


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:选择题
| A. | 石油和天然气的主要成分都是碳氢化合物 | |
| B. | 甲烷和乙烯都能与Cl2发生反应 | |
| C. | 乙烯可以合成有机高分子材料 | |
| D. | 苯和乙醇都能被酸性KMnO4溶液氧化而使KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 金属(相同粉末状) 和物质的量(mol) | 酸的浓度和体积(mL) | 反应温度 | |||
| A | Fe | 0.1 | 3mol/L HCl | 10 | 20℃ |
| B | Al | 0.1 | 3mol/L HCl | 10 | 20℃ |
| C | Cu | 0.1 | 4mol/L H2SO4 | 10 | 20℃ |
| D | Mg | 0.1 | 稀6mol/L HNO3 | 10 | 20℃ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数关系:C>B>A | B. | 微粒半径关系:Bn->C>An+ | ||
| C. | C微粒是稀有气体元素的原子. | D. | 原子半径关系是:B>A>C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
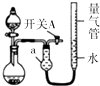 某同学设计图所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:
某同学设计图所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:| 实验 | 药品 | 制取气体 | 量气管中的液体 |
| ① | Cu、浓HNO3 | H2O | |
| ② | CaO固体、浓氨水 | NH3 | |
| ③ | 粗镁、稀H2SO4 (足量)[杂质不与硫酸反应] | H2 | H2O |
| 编号 | 镁(含杂质)质量 | 量气管第一次读数 | 量气管第二次读数 |
| 1 | 0.5g | 10.0mL | 346.5mL |
| 2 | 0.5g | 10.0mL | 335.0mL |
| 3 | 0.5g | 10.0mL | 345.5mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com