
| X | Y | Z |
| W | ||
| T |
| A. | Y、W、T元素的原子半径及它们气态氢化物的还原性均依次递增 | |
| B. | Z氢化物的沸点一定比 X氢化物的沸点高 | |
| C. | X、Y元素形成的常见单质的化学键类型相同 | |
| D. | 根据元素周期律,可以推测存在化学式为T2Z3、X3Y4的两种物质,T元素存在同素异形现象 |
分析 X、Y、Z、W为短周期元素,T为第四周期元素,则Z在第二周期,Z元素的原子最外层电子数是其核电荷数的$\frac{3}{4}$,设最外层电子数为x,则核电荷数为2+x,则$\frac{x}{2+x}$=$\frac{3}{4}$,解得x=6,所以Z是O,根据元素周期表位置关系,推出X是C,Y是N,W是P,T是As.
解答 解:X、Y、Z、W为短周期元素,T为第四周期元素,则Z在第二周期,Z元素的原子最外层电子数是其核电荷数的$\frac{3}{4}$,设最外层电子数为x,则核电荷数为2+x,则$\frac{x}{2+x}$=$\frac{3}{4}$,解得x=6,所以Z是O,根据元素周期表位置关系,推出X是C,Y是N,W是P,T是As,
A.Y、W、T位于同主族,从上到下,原子半径逐渐增大,非金属性逐渐减弱,气态氢化物的还原性依次增强,故A正确;
B.Z的氢化物是水,水分子间存在氢键,使水的沸点较高,常温下是液体,但是X的氢化物是碳的氢化物,碳的氢化物有气态烃、液态烃、固态烃,则Z氢化物的沸点不一定比X氢化物的沸点高,故B错误;
C.X、Y元素是非金属元素,形成的常见单质中是以共价键的方式达到稳定结构,故C正确;
D.X是C位于第ⅣA族,最高化合价是+4,Y位于第ⅤA族,最低负价是-3价,则可以推测存在化学式X3Y4,T是As位于第ⅤA族,常见化合价有+3、+5,Z位于第ⅥA族,最低负价是-2价,故存在T2Z3,即As2O3是存在的;W为P,红磷与白磷是同素异形体,W、T处同一周期,推测T元素也存在同素异形现象,故D正确;
故选:B.
点评 本题主要考查了常见元素化合知识及原子结构、元素周期律等知识,解题的关键是利用数学计算推出Z,比较沸点时既要注意氢键对沸点的影响,还要看清是不是气态氢化物.


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 石油的裂化、煤的液化、蛋白质的盐析、焰色反应都是化学变化 | |
| B. | 在元素周期表的金属和非金属分界线附近可寻找锗、硅、硒等半导体材料 | |
| C. | 铅蓄电池是常见的二次电池.性能优良.比能量高.缺点是废弃电池污染严重 | |
| D. | 在新型催化剂条件下通过电力可将二氧化碳氧化为甲醇、甲烷等燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X与Y可以形成5种以上的化合物 | |
| B. | M的氧化物对应的水化物的酸性一定比W的强 | |
| C. | W的气态氢化物与M的单质能发生置换反应 | |
| D. | Z、M的单质在一定探究下均能和强碱溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
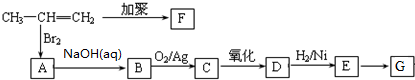
 .聚合物G的结构简式
.聚合物G的结构简式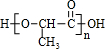 _
_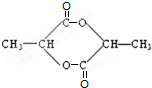 .
. .
.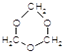 B.
B.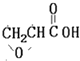 C.
C.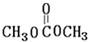 D.HOCH2CH2COOH.
D.HOCH2CH2COOH.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

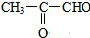 +2H2O.
+2H2O.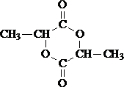 .
.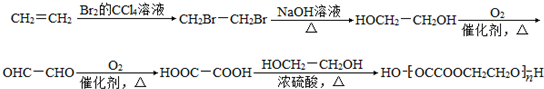 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据以上信息,可推断CH3COOH为弱电解质 | |
| B. | 加水稀释过程中,c(H+)•c(OH-) 的值增大 | |
| C. | 加入NaOH固体可抑制 CHCOO-的水解 | |
| D. | 同pH的CH3COONa溶液和NaOH溶液,由水电离出的c(H+) 前者大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 25℃,在100mL 0.1mol?L-1的两种一元酸HX、HY的溶液中,分别加入NaOH固体,lg$\frac{c({H}^{+})}{c(O{H}^{-})}$随加入NaOH的物质的量的变化如图所示.下列叙述不正确的是( )
25℃,在100mL 0.1mol?L-1的两种一元酸HX、HY的溶液中,分别加入NaOH固体,lg$\frac{c({H}^{+})}{c(O{H}^{-})}$随加入NaOH的物质的量的变化如图所示.下列叙述不正确的是( )| A. | 酸性:HX>HY | |
| B. | a点由水电离出的c(H+)=10-12 mol?L-1 | |
| C. | c点溶液中:c(Y-)>c(HY) | |
| D. | b点时,溶液pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molCl2和足量的铁加热条件下反应,转移电子数一定为3NA | |
| B. | 28g乙烯和丙烯的混合物中含有双键数目小于NA | |
| C. | 常温下,PH=13的Ba(OH)2 溶液,0.1L,含OH-,0.02NA | |
| D. | 1 L 1 mol/L的甲醇水溶液中含有氢原子总数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com