
已知在中性条件下钢铁易发生吸氧腐蚀时,正极上发生的电极反应是()
A. 2H++2e﹣→H2 B. Fe2++3e→Fe
C. 2H2O+O2+4e﹣→4OH﹣ D. Fe3+﹣e→Fe3+
科目:高中化学 来源: 题型:
下列有关化学反应速率的说法正确的是()
A. 用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率
B. 100mL2mol•L﹣1的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变
C. SO2的催化氧化是一个放热的反应,所以升高温度,反应速率减慢
D. 汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率减慢
查看答案和解析>>
科目:高中化学 来源: 题型:
VL Fe2(SO4)3溶液中含有Fe3+mg,则溶液中SO42﹣的物质的量浓度为()
A. 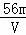 mol/L B.
mol/L B. 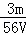 mol/L C.
mol/L C. 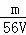 mol/L D.
mol/L D. 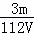 mol/L
mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
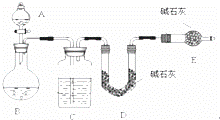
某化学兴趣小组采用下列方法测定Na2SO3样品中Na2SO4的质量分数.
【方法一】测 SO2质量法采用如图所示装置,通过实验测定生成SO2的质量.
(1)C中盛放的试剂是 ,E装置的作用是
(2)若实验前称取m1g样品,再测得SO2的质量为m2g,则可得Na2SO4质量分数,其中m2是通过测定 (填装置符号)装置在实验前后的质量差得到的.该方法的缺点是(只答一点).
【方法二】测沉淀质量法
第一步:称取m3g样品,置于小烧杯中 第二步:向小烧杯中加入足量稀盐酸,加热
第三步:再向小烧杯中加入足量BaCl2溶液,然后过滤、洗涤 第四步:干燥沉淀,称重为m4g
(3)简述洗涤沉淀的方法: .
(4)若m3=2m4 则试样中Na2SO4的质量分数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关原子结构和元素周期律的表述正确的是()
①原子序数为15的元素的最高化合价为+3
②第ⅦA族元素是同周期中非金属性最强的元素
③第ⅥA族元素的原子最高正价等于主族序数
④原子序数为12的元素位于元素周期表的第三周期第ⅡA族.
A. ①② B. ①③ C. ②④ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示装置中,观察到电流计指针偏转;M棒变粗,N棒变细.由此判断下表中所列M、N、P物质,其中可以成立的是()
M N P
A 锌 铜 稀硫酸溶液
B 铜 铁 稀盐酸
C 银 锌 硝酸银溶液
D 锌 铁 硝酸铁溶液
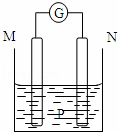
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
将铂丝插入KOH溶液中做电极,并在两极片上分别通入甲烷和氧气,形成一种燃料电池,在该电池反应中,甲烷发生类似于燃烧的反应,根据以上判断:
(1)通甲烷的铂丝为原电池的极,发生的电极反应为 .
(2)该电池工作时(放电)反应的总化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
对下列化学反应的热现象,不正确的说法是()
A. 有些放热反应发生时需要加热
B. 化学反应一定既有物质变化又有能量变化
C. 吸热反应都需要加热后才能发生
D. 化学反应热效应数值与反应物质多少有关
查看答案和解析>>
科目:高中化学 来源: 题型:
灰锡(以粉末状存在)和白锡是锡的两种同素异形体.已知:
①Sn(s,白)+2HCl(aq)═SnCl2(aq)+H2(g)△H1
②Sn(s,灰)+2HCl(aq)═SnCl2(aq)+H2(g)△H2
③Sn(s,灰) Sn(s,白)△H3=+2.1kJ•mol﹣1,
Sn(s,白)△H3=+2.1kJ•mol﹣1,
下列说法正确的是()
A. △H1>△H2
B. 锡在常温下以灰锡状态存在
C. 灰锡转为白锡的反应是放热反应
D. 锡制器皿长期处在低于13.2℃的环境中,会自行毁坏
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com