


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:


| ①O3 |
| ②Zn/H2O |
 +R3CHO,根据已有知识并结合相关信息,写出以
+R3CHO,根据已有知识并结合相关信息,写出以 为原料制备
为原料制备 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:| NaOH溶液 |
| △ |
| CH3COOH |
| 浓H2SO4△ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③ | B、②③ |
| C、③④ | D、②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SiCl4、PCl5分子中各原子最外层均达到8电子稳定结构 |
B、右表中的数字代表的是元素的原子序数.表中数字所对应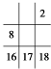 的元素与它们在周期表中的位置是相符的 的元素与它们在周期表中的位置是相符的 |
| C、元素的化学性质主要决定于核外电子数 |
| D、元素周期表中金属和非金属元素分界线附近的元素没有用于制造半导体材料的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com