
【题目】工业上用铝土矿![]() 主要成分为
主要成分为![]() 、
、![]() 、
、![]() 提取氧化铝做冶炼铝的原料,提取的操作流程如下:
提取氧化铝做冶炼铝的原料,提取的操作流程如下:
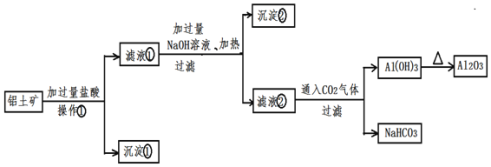
请回答下列问题:
![]() 操作
操作![]() 的名称:______
的名称:______
![]() 沉淀
沉淀![]() 的化学式:______沉淀
的化学式:______沉淀![]() 的化学式:______
的化学式:______
![]() 写出沉淀
写出沉淀![]() 与NaOH溶液反应的化学方程式:______
与NaOH溶液反应的化学方程式:______
![]() 写出滤液
写出滤液![]() 与NaOH溶液反应生成沉淀
与NaOH溶液反应生成沉淀![]() 的离子方程式:______
的离子方程式:______
![]() 尝试写出滤液
尝试写出滤液![]() 中通入
中通入![]() 后的反应方程式:______
后的反应方程式:______
【答案】过滤 ![]()
![]()
![]()
![]()
![]()
【解析】
由流程可知,加盐酸,只有SiO2不反应,氧化铝、氧化铁均与盐酸反应,操作①为过滤,沉淀①为SiO2;滤液①中加过量NaOH,铝离子转化为偏铝酸钠,铁离子转化沉淀,过滤后,沉淀②为Fe(OH)3,滤液②含NaOH、偏铝酸钠,与二氧化碳反应生成氢氧化铝和碳酸氢钠,最后氢氧化铝分解生成氧化铝,以此来解答。
(1)由上述分析可知,操作![]() 的名称:过滤,故答案为:过滤;
的名称:过滤,故答案为:过滤;
(2)沉淀![]() 的化学式为
的化学式为![]() ,沉淀
,沉淀![]() 的化学式为
的化学式为![]() ,故答案为:
,故答案为:![]() ;
;![]() ;
;
(3)沉淀![]() 与NaOH溶液反应的化学方程式为
与NaOH溶液反应的化学方程式为![]() ,故答案为:
,故答案为:![]() ;
;
(4)滤液![]() 与NaOH溶液反应生成沉淀
与NaOH溶液反应生成沉淀![]() 的离子方程式为
的离子方程式为![]() ,故答案为:
,故答案为:![]() ;
;
(5)滤液![]() 中通入
中通入![]() 后的反应方程式为
后的反应方程式为![]() ,故答案为:
,故答案为:![]() 。
。


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】下列实验结论与实验操作及现象不相符的一组是( )
选项 | 实验操作及现象 | 实验结论 |
A | 向某酸雨样品中加入Ba(OH)2溶液,有白色沉淀生成 | 酸雨试样中一定含SO42- |
B | 向KI-淀粉溶液中滴入氯水,溶液变成蓝色 | I-的还原性强于Cl- |
C | 将Ba(OH)2·8H2O和NH4Cl晶体在小烧杯中混合搅拌,用手触摸烧杯外壁感觉变凉 | Ba(OH)2·8H2O与NH4Cl的反应是吸热反应 |
D | 向某盐溶液中加入NaOH溶液,加热,用湿润的红色石蕊试纸放在试管口,试纸变蓝 | 该盐溶液中含有NH4+ |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生态工业园区的建设,不仅仅是体现环保理念,重要依据循环经济理论和充分考虑经济的可持续发展,如图是某企业设计的硫酸-磷铵-水泥联产,海水-淡水多用,盐-热-电联产生三大生态产业链流程图。根据上述产业流程回答下列问题:
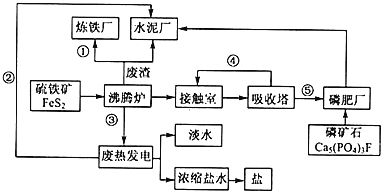
(1)从原料、能源、交通角度考虑该企业应建在______
A西部山区 B沿海地区 C发达城市 D东北内陆
(2)该流程①、②、③、④、⑤为能量或物质的输送,请分别写出输送的主要物质的化学式或能量形式:①______、②______、③______、④______、⑤______。
(3)沸腾炉发生反应的化学方程式:______;磷肥厂的主要产品是普钙,其主要成分是______(填化学式)。
(4)热电厂的冷却水是______,该流程中浓缩盐水除提取盐以外还可提取的物质有______(写出一种即可)。
(5)根据现代化工厂没计理念请提出高炉炼铁厂废气、废渣及多余热能的利用设想。______,______(写出两点即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.Penguinone分子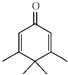 所有碳原子不可能都在同一个平面上
所有碳原子不可能都在同一个平面上
B.1mol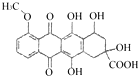 分别与足量的Na、NaOH溶液、
分别与足量的Na、NaOH溶液、![]() 溶液反应,消耗这三种物质的物质的量分别为5mol、3mol、1mol
溶液反应,消耗这三种物质的物质的量分别为5mol、3mol、1mol
C.醋酸和软脂酸互为同系物,![]() 和
和![]() 也一定互为同系物
也一定互为同系物
D.蛋白质遇到醋酸铅生成沉淀,加入大量的水,沉淀还可溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A(g)+B(g)![]() 3C(g)+4D(g)反应中,表示该反应速率最快的是
3C(g)+4D(g)反应中,表示该反应速率最快的是
A.v(A)=8 mol·L-1·min-1B.v(B)=0.3 mol·L-1·s-1
C.v(C)=0.8 mol·L-1·s-1D.v(D)=1 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的工业废水中含有大量的![]() ,较多的
,较多的![]() 和少量
和少量![]() 为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜.请根据下列流程图,完成回收硫酸亚铁和铜的实验方案。
为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜.请根据下列流程图,完成回收硫酸亚铁和铜的实验方案。![]() 可供选择的试剂为铁粉、稀
可供选择的试剂为铁粉、稀![]() 、NaOH溶液等试剂
、NaOH溶液等试剂![]()
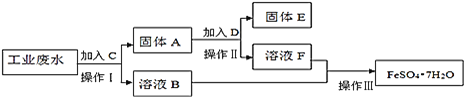
![]() 操作Ⅰ的名称为 ______ ,所需要的玻璃仪器有 ______ ;
操作Ⅰ的名称为 ______ ,所需要的玻璃仪器有 ______ ;
![]() 固体A的成分为 ______ ,溶液B中含有的离子有 ______
固体A的成分为 ______ ,溶液B中含有的离子有 ______
![]() 加入试剂C的目的是 ______ ,发生的化学方程式为 ______ ;
加入试剂C的目的是 ______ ,发生的化学方程式为 ______ ;
![]() 加入的试剂D为 ______ ,发生的离子方程式为 ______ ;
加入的试剂D为 ______ ,发生的离子方程式为 ______ ;
![]() 操作Ⅲ为 ______ 。
操作Ⅲ为 ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C(s)+H2O(g)![]() CO(g)+H2(g)在一密闭容器中进行,下列说法正确是
CO(g)+H2(g)在一密闭容器中进行,下列说法正确是
A.保持容器体积不变,增加C的物质的量,反应速率增大
B.保持容器体积不变,充入N2容器内气体压强增大,化学反应速率增大
C.保持压强不变,充入N2容器内气体压强不变,化学反应速率减小
D.保持容器体积不变,随着反应进行气体物质的量增多,压强增大,反应速率逐渐加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以废镍(含NiO,杂质为少量Fe2O3)生产Ni2O3的一种工艺流程如下:
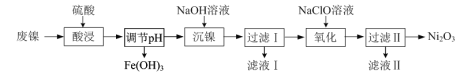
(1)“调节pH”后检验溶液中不再存在Fe3+的方法是______。
(2)“沉镍”的目的是将溶液中的Ni2+转化为Ni(OH)2沉淀,确认Ni2+已经完全沉淀的实验方法是______。
(3)“滤液Ⅱ”所含阴离子主要为Cl-,写出“氧化”时反应的离子方程式:______。
(4)若“氧化”反应不充分,所制Ni2O3样品中会混有Ni(OH)2。为测定样品中Ni2O3的质量分数,进行实验:称取5.000 g样品,加入足量硫酸后再加入100 mL 1.0 mol·L-1的Fe2+标准溶液,充分反应,加水定容至200 mL。取出20.00 mL,用0.040 mol·L-1 KMnO4标准溶液滴定,用去KMnO4标准溶液20.00 mL,试通过计算确定Ni2O3的质量分数。测定过程中涉及反应如下:Ni2O3+Fe2++H+=Ni2++Fe3++H2O(未配平);Fe2++MnO4-+H+=Fe3++Mn2++H2O(未配平)______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向一定体积0.1 mol/L的醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液pOH[pOH=-lgc(OH-)]与pH的变化关系如图所示,则( )

A.N点处pH>pOH,则N点处所示溶液呈酸性
B.该温度下水的离子积Kw=1×10-2a
C.Q点所示溶液呈中性,则M、N、Q三点中只有Q点溶液中水的电离出的c(H+)与水的电离c(OH-)相等
D.M点所示溶液的导电能力强于Q
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com