
在饱和Na2CO3溶液中通入二氧化碳会有晶体析出,在饱和NaCl溶液中通入CO2则不发生化学反应。若在饱和NaCl溶液中通入氨气后,再通入CO2则会有晶体析出,简述其原因并写出相应的化学方程式。
饱和Na2CO3溶液中通入CO2时,所发生的化学反应是:Na2CO3+CO2+H2O====
2NaHCO3;在饱和NaCl溶液中通入足量氨气以后再通入CO2时,则发生以下反应:
NH3+CO2+H2O====NH4HCO3
NH4HCO3+NaCl====NH4Cl+NaHCO3↓
其中NaHCO3溶解度最小,故有NaHCO3的晶体析出。
在Na2CO3饱和溶液中通入CO2时,由于Na2CO3易溶于水,且发生反应Na2CO3+CO2+H2O
====2NaHCO3,而生成的NaHCO3溶解度小,所以随着CO2气体的通入,会有NaHCO3晶体析出。
氯化钠是强酸盐,CO2是弱酸的酸酐,根据复分解反应规律,CO2不能与NaCl溶液反应。通入足量氨气的饱和NaCl溶液中再通入CO2时,CO2跟氨水反应生成NH4HCO3,当溶液中Na+、Cl-、![]() 、
、![]() 等离子浓度都较大时,首先是微溶于水的NaHCO3析出。
等离子浓度都较大时,首先是微溶于水的NaHCO3析出。


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:
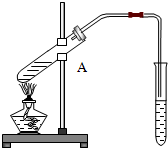 右图是实验室制乙酸乙酯的实验装置图:
右图是实验室制乙酸乙酯的实验装置图:查看答案和解析>>
科目:高中化学 来源: 题型:
| H2SO4浓 |
| 140℃ |

| 浓硫酸 |
| 170℃ |
| 浓硫酸 |
| 170℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:
乙醇的沸点是78 ℃,能与水以任意比例混溶。乙醚(CH3CH2OCH2CH3)的沸点为34.6 ℃,难溶于水,在饱和Na2CO3溶液中几乎不溶,乙醚极易燃烧。实验室制乙醚的反应原理如下:
2CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
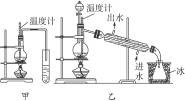
图6-3
(1)图6-3中甲和乙是两套实验室制乙醚的装置,选择装置__________最合适,理由是______________________________。
(2)反应液中应加入沸石,其作用是________________________________________。
(3)反应中温度计的位置应在____________________。
(4)用装置乙制得的乙醚中可能含有大量杂质,这种杂质是__________,除去这种杂质的简易方法是____________________。
(5)如果反应温度太高将会发生__________反应,产物是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(12分)乙醇的沸点是78℃,能与水以任意比例混溶。乙醚的沸点为34.6℃,难溶于水,在饱和Na2CO3溶液中几乎不溶,乙醚极易燃烧。实验室制乙醚的反应原理是
![]()

(1)图甲和乙是两套实验室制乙醚的装置,选装置 最合适,理由是 __ 。
(2)反应液中应加入沸石,其作用是 。
(3)反应中温度计水银球的位置是 __________________ 。
(4)用装置乙制得的乙醚中可能含有大量的杂质,这杂质是 ,除去这种杂质的简易方法是 。
(5)如果温度太高将会有乙烯生成,该反应的化学方程式是
,反应类型是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(8分)乙醇的沸点是78℃,能与水以任意比例混溶。乙醚的沸点为34.6℃,
难溶于水,在饱和Na2CO3溶液中几乎不溶,乙醚极易燃烧。实验室制乙醚的
反应原理是

(1) 图甲和乙是两套实验室制乙醚的装置,选装置 最合适。
(2)反应液中应加入沸石,其作用是 。
(3)反应中温度计的位置是 。
(4)用装置乙制得的乙醚中可能含有大量的乙醇,除去乙醇的简易方法是 。
(5) 如果温度太高将会发生另一有机反应,此反应方程式为
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com