
【题目】按要求填写下列空格。
(1)写出镍(Ni)的基态原子核外电子排布式__________________________。
(2)画出氮(N)原子价电子的电子排布图___________________________。
(3)CH≡CCH(CH3)2系统命名法命名为______________________。
(4)2,3-二甲基-1-丁烯的结构简式为___________________________。
(5)支链只有一个乙基且式量最小的烷烃的结构简式为_____________________。
【答案】1s22s22p63s23p63d84s2或[Ar]3d84s2 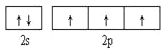 3-甲基-1-丁炔 CH2=C(CH3)CH(CH3)2 CH(CH2CH3)3
3-甲基-1-丁炔 CH2=C(CH3)CH(CH3)2 CH(CH2CH3)3
【解析】
(1)镍(Ni)的核电荷数为28,基态镍原子核外电子排布式为1s22s22p63s23p63d84s2或[Ar]3d84s2;
(2) N原子核外电子排布式是1s22s22p3,结合泡利原理、洪特规则,其核外电子排布图为![]() ;
;
(3)CH≡CCH(CH3)2的主链是4个碳原子,根据系统命名法命名为3-甲基-1-丁炔;
(4)根据烯烃系统命名法,可知2,3-二甲基-1-丁烯的结构简式为CH2=C(CH3)CH(CH3)2;
(5)根据烷烃的系统命名法,主链的3号碳原子上才有可能有乙基,则支链只有一个乙基且式量最小的烷烃的结构简式为CH(CH2CH3)3。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】通常情况下,多个羟基连在同一个碳原子上的分子结构是不稳定的,容易自动失水,生成碳氧双键的结构:
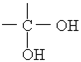 →
→![]() +H2O
+H2O
如图是9个化合物的转变关系:
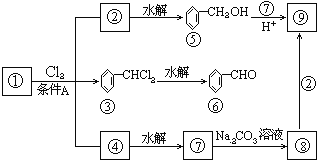
(1)化合物①的结构简式为_______,它跟氯气发生反应的条件A是_______。⑦的结构式为________。
(2)化合物⑤跟⑦可在酸的催化下去水生成化合物⑨,⑨的结构简式是________。
(3)写出③→⑥的化学方程式________。
(4)化合物⑨是重要的定香剂,香料工业上常用化合物②和⑧直接合成它。此反应类型为_____。反应的化学方程式是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20 ℃时,饱和氯化钾溶液的密度为1.174 g/mL,物质的量浓度为4.0 mol/L,则下列说法中正确的是
A.25 ℃时,饱和氯化钾溶液的浓度小于4.0 mol/L
B.此溶液中氯化钾的质量分数为![]() ×100%
×100%
C.20 ℃时,密度小于1.174 g/mL的氯化钾溶液是不饱和溶液
D.将此溶液蒸发部分水,再恢复到20 ℃时,溶液密度一定大于1.174 g/mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)是白色粉末,微溶于水,酸性条件下不稳定,易生成金属 Cu 和Cu2+,广泛应用于化工和印染等行业。某研究性学习小组拟热分解 CuC122H2O 制备 CuCl,并进行相关探究。下列说法不正确的是( )
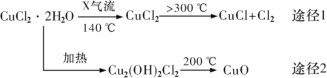
A.途径 1 中产生的Cl2 可以回收循环利用
B.途径 2 中 200℃时反应的化学方程式为:Cu2(OH)2Cl2![]() 2CuO+2HCl↑
2CuO+2HCl↑
C.X 气体是HCl,目的是抑制 CuCl22H2O 加热过程可能的水解
D.CuCl 与稀硫酸反应的离子方程式为:2CuCl+4H++SO42—=2Cu2++2Cl—+SO2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图装置中,若关闭活塞,则品红溶液无变化,石蕊试液变红,澄清石灰水变浑浊;若打开活塞,则品红溶液褪色,石蕊试液变红,澄清石灰水变浑浊。据此判断气体和广口瓶中盛放的物质是( )
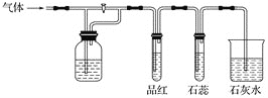
A. 二氧化硫和浓硫酸
B. 二氧化硫和碳酸氢钠溶液
C. 氯气和氢氧化钠溶液
D. 二氧化碳和氢氧化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】主族元素X、Y、Z、W的原子序数依次增加,且均不大于20,X的单质是手机电池重要的电极材料;常温下,Y的两种气态氧化物之间可发生可逆反应;X、Y、W最外层电子数之和与Z的最外层电子数相等;W能形成多种氧化物。下列说法正确的是
A.常温下,Z的单质与Y的简单氢化物相遇,可能产生白烟
B.Z非金属性强于Y,其对应含氧酸的酸性:Z>Y
C.原子半径:X>Y;简单离子半径:Z<W
D.X、W的单质均为活泼金属,通常保存在煤油中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在温度T1和T2时水的电离平衡曲线如图所示,下列说法错误的是( )
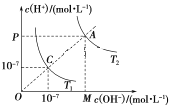
A.水的离子积常数关系为:C<A
B.升高温度可实现由C点到A点
C.T2时,pH=4的硫酸与pH=10的氢氧化钠溶液等体积混合,所得溶液的pH=7
D.图中矩形OMAP的面积表示T2时水的离子积的值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红帘石矿的主要成分为Fe3O4、Al2O3、MnCO3、MgO少量MnO2等。工业上将红帘石处理后运用阴离子膜电解法的新技术提取金属锰并制得绿色高效的水处理剂(K2FeO4)。工业流程如下:
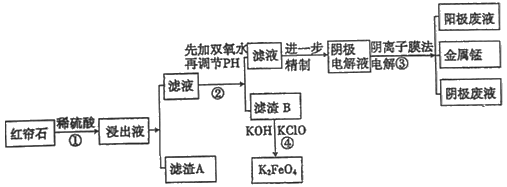
(1)在稀硫酸浸取矿石的过程中,MnO2可将Fe2+氧化为Fe3+,写出该反应的离子方程式:___________________。
(2)浸出液中的阳离子除H+、Fe2+、Fe3+外还有_____________(填离子符号)。
(3)已知不同金属离子生成氢氧化物沉淀所需的pH如下表:
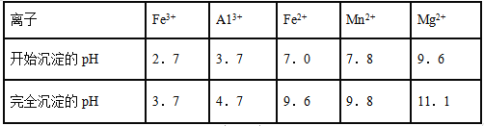
步骤②中调节溶液的pH等于6,调节pH的试剂最好选用下列哪种试剂__________(填选项字母,下同)滤渣B除掉杂质后可进一步制取K2FeO4,除掉滤渣B中杂质最好选用下列哪种试剂:________。
a. 稀盐酸 b. KOH c. 氨水 d. MnCO3 e. CaCO3
(4)滤渣B经反应④生成高效水处理剂的离子方程式_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com