
【题目】T℃时,向2.0L恒容密闭容器中充入0.80molA,发生反应:![]()
![]() ,经一段时间后达到平衡。反应过程中测定的部分数据见表:
,经一段时间后达到平衡。反应过程中测定的部分数据见表:
时间/min | 0 | 10 | 20 | 30 | 40 |
| 0.80 | 0.60 | 0.48 |
|
|
| 0.00 | 0.20 |
| 0.40 | 0.40 |
下列说法不正确的是
A.该反应在30min时已达到平衡
B.反应在前20min的平均速率为![]()
C.保持其他条件不变,升高温度,平衡时,![]() ,则
,则![]()
D.相同温度下,起始时向容器中充入0.10molA、0.10molB和0.30molC,达到平衡前的反应速率:v逆>v正
【答案】D
【解析】
前30min,B的物质的量增大了0.40mol,30min之后,B的物质的量不再增大,说明该反应在30min时已达到平衡。因为A和B的计量数都为1,A的物质的量减小量=B的物质的量增大量=0.40mol,所以n2=n3=0.80mol-0.40mol=0.40mol,据此解答。
A.30min之后,B的物质的量不再改变,说明该反应在30min时已达到平衡,A正确;
B.反应在前20min的平均速率![]() ,所以v(C)=v(A)=
,所以v(C)=v(A)=![]() ,B正确;
,B正确;
C.由分析可知,T℃时达到平衡,c(A)=![]() ,保持其他条件不变,升高温度,平衡时,
,保持其他条件不变,升高温度,平衡时,![]() <0.2
<0.2![]() ,说明升高温度,平衡正向移动,该反应的正反应为吸热反应,
,说明升高温度,平衡正向移动,该反应的正反应为吸热反应,![]() >0,即
>0,即![]() ,C正确;
,C正确;
D.T℃平衡时,c(B)=c(C)=![]() ,c(A)=
,c(A)=![]() 该反应的平衡常数K=
该反应的平衡常数K=![]() =0.2mol/L,相同温度下,起始时向容器中充入0.10molA、0.10molB和0.30molC,QC=
=0.2mol/L,相同温度下,起始时向容器中充入0.10molA、0.10molB和0.30molC,QC=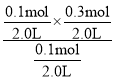 =0.15mol/L,QC<K,平衡正向进行,v逆<v正,D错误。
=0.15mol/L,QC<K,平衡正向进行,v逆<v正,D错误。
答案选D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列有关说法正确的是( )
A.1L0.1molL-1NaNO2溶液中NO2-的数目为0.1NA
B.3.1g乙二醇中含有羟基的数目为NA
C.5.85gNa37Cl中所含质子总数为2.8NA
D.2.4g镁条在足量的由N2和O2组成的混合气体中完全燃烧时,转移的电子总数一定为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一块金属钠露置于空气中,观察到下列现象:金属钠银白色![]() 变灰暗
变灰暗![]() 变白色
变白色![]() 表面潮湿
表面潮湿![]() 形成白色晶体
形成白色晶体![]() 形成白色粉末。据此判断下列说法中不正确的是( )
形成白色粉末。据此判断下列说法中不正确的是( )
A.过程⑤最终形成的白色粉末是![]()
B.过程④是氢氧化钠溶液吸收空气中的![]() 、水蒸气形成了碳酸氢钠晶体
、水蒸气形成了碳酸氢钠晶体
C.过程③中,是因为氢氧化钠具有很强吸湿性,吸收空气中的水分子,最后会完全溶解成溶液
D.整个变化过程中只有一个氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实,不能用勒夏特列原理解释的是
A.在溴水中存在如下平衡:Br2+H2O![]() HBr+HBrO,当加入NaOH溶液后颜色变浅
HBr+HBrO,当加入NaOH溶液后颜色变浅
B.对于反应:2HI(g)![]() H2(g)+I2(g),使平衡体系缩小体积增加压强,颜色变深
H2(g)+I2(g),使平衡体系缩小体积增加压强,颜色变深
C.Fe(SCN)3溶液中加入固体KSCN后颜色变深
D.棕红色气体NO2(2NO2![]() N2O4)缩小体积加压后,颜色先变深后变浅
N2O4)缩小体积加压后,颜色先变深后变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为减轻大气污染,必须要加强对工业废气和汽车尾气的治理,根据所学知识回答下列问题:
(1)化石燃料包括煤、石油和________。
(2)酸雨是指pH____(填“>”“<”或“=”)5.6的降水,煤的燃烧是导致酸雨形成的主要原因,而正常雨水的pH约为5.6,原因是__________________ (用化学方程式表示)。
(3)煤的气化是高效、清洁利用煤的重要途径,可将煤炼成焦炭,再将焦炭在高温下与水蒸气反应生成一氧化碳和氢气的化学方程式为_________,该反应的基本类型是_________。
(4)在汽车尾气排放口加装“三效催化净化器”,在不消耗其他物质的情况下,可将尾气中的一氧化碳、一氧化氮转化为参与大气循环的气体和无毒的气体,该反应的化学方程式为__________________。
(5)在新能源汽车未普及时,如图所示为一种“节能减排”的有效措施,以下对乙醇作汽车燃料的描述错误的是__________(填字母)。
![]()
A.原料来源丰富 B.是可再生能源 C.燃烧完全没有污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个1L的密闭容器中,加入2molA和1molB,发生下述反应:2A(g)+B(g)![]() 3C(g)+D(g)达到平衡时,C的浓度为1.2mol/L,C的体积分数为a%。维持容器的压强和温度不变,按下列配比作为起始物质,达到平衡后,C的浓度不再是1.2mol/L的是
3C(g)+D(g)达到平衡时,C的浓度为1.2mol/L,C的体积分数为a%。维持容器的压强和温度不变,按下列配比作为起始物质,达到平衡后,C的浓度不再是1.2mol/L的是
A.3mol C+1mol DB.1mol A+0.5mol B+1.5mol C+0.5mol D
C.1mol A+0.5mol B+1.5mol CD.4molA+2mol B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图装置进行实验:加热钠至熔化后,停止加热并通入氯气,钠剧烈燃烧并生成大量白烟。以下叙述错误的是
![]()
A. 钠着火燃烧产生苍白色火焰
B. 反应生成的大量白烟是氯化钠固体小颗粒
C. 棉球处发生的化学反应是: Cl2+2NaOH=NaCl+NaClO+H2O
D. 可在棉球右侧用湿润的淀粉碘化钾试纸判断氯气是否被碱液完全吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.铁粉放入稀硫酸溶液:2Fe+6H+═2Fe3++3H2↑
B.往NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH﹣![]() NH3↑+H2O
NH3↑+H2O
C.石灰石与稀盐酸反应:CO32﹣+2H+═ CO2↑+H2O
D.Cl2通入水中:Cl2+H2O = H++Cl﹣+HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某粗盐样品中含有Na2SO4、MgCl2、CaCl2等杂质.实验室提纯流程如下:
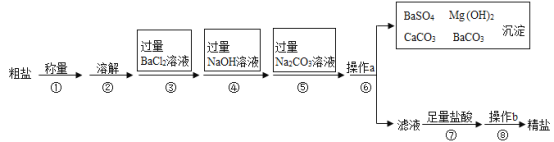
(1)用托盘天平称量粗盐时,若砝码和粗盐位置放颠倒,天平平衡时,读数为5.4g,实际称得粗盐的质量是__________。
A.5.4g B.4.6g C.6.0g D.5.0g
(2)第③步操作发生反应的化学方程式是__________________________
(3)第④步操作发生反应的化学方程式是_______________________
(4)第⑤步操作的目的是 ___________________________
(5)第⑥步操作a的名称是 ________,此步操作中,玻璃棒的末端要轻轻地斜靠在 _____________的一边。
(6)第⑦步操作中,向滤液中滴加足量盐酸的目的是_____________,此步操作中产生气泡的化学方程式是___________________。
(7)在第⑧步操作时,要用玻璃棒不断搅拌,目的是_______________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com