

| A. | 制取SO2 | B. | 验证漂白性 | C. | 收集SO2 | D. | 尾气处理 |
分析 实验室可用浓硫酸和铜在加热条件下反应制备二氧化硫,二氧化硫密度比空气大,可用向上排空气法收集,具有漂白性,可使品红褪色,二氧化硫为酸性氧化物,可与碱反应,以此解答该题.
解答 解:A.稀硫酸和铜不反应,应用浓硫酸和铜反应制备二氧化硫气体,故A错误;
B.二氧化硫具有漂白性,可使品红褪色,操作符合要求,可达到实验目的,故B正确;
C.二氧化硫密度比空气大,可用向上排空气法收集,气体应从长导管进入,故C错误;
D.二氧化硫不溶于饱和亚硫酸氢钠溶液,应用氢氧化钠溶液吸收尾气,且防止倒吸,故D错误.
故选B.
点评 本题考查较为综合,涉及气体的制备、收集以及性质的检验等,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质的异同以及实验的严密性和可行性的评价,难度中等


 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:解答题

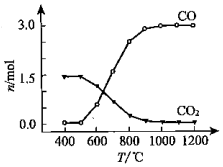
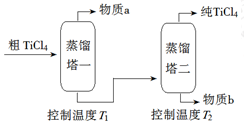
| 化合物 | SiCl4 | TiCl4 | AlCl3 | FeCl3 | MgCl2 |
| 沸点/℃ | 58 | 136 | 181(升华) | 316 | 1412 |
| 熔点/℃ | -69 | 25 | 193 | 304 | 714 |
| 在TiCl4中的溶解性 | 互溶 | - | 微溶 | 难溶 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色透明的溶液中:Fe3+、Mg2+、SCN -、Cl - | |
| B. | c(H+)/c(OH-)=1×10 -12的溶液中:K+、Na+、CO32-、NO3- | |
| C. | c(Fe2+ )=1 mol•L-1的溶液中:K+、NH4+、MnO4-、SO42- | |
| D. | 能使甲基橙变红的溶液中:Na+、NH4+、SO42-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
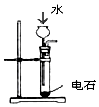 |  | 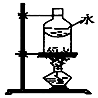 |  |
| 制乙炔的发生装置 | 蒸馏时的接收装置 | 分离固体氯化钠和碘单质 | 准确量取一定体积K2Cr2O7标准溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象及结论 |
| A | 将AlC13溶液加热蒸干 | 得到白色固体,成分为纯净的AlC13 |
| B | 将少量Na2SO3样品溶于水,滴加足量盐酸酸化的Ba(NO3)2溶液 | 有白色沉淀产生,则Na2SO3己变质 |
| C | 用量筒量取一定体积的浓硫酸时,仰视读数 | 所量取的浓硫酸体积偏大 |
| D | 向FeI2溶液中通入少量C12 | 溶液变黄,则C12的氧化性强于Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
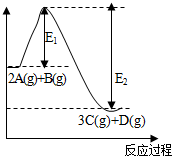 反应2A(g)+B(g)?3C(g)+D(g),△H=akJ/mol.反应过程中的能量变化如图所示.回答下列问题:
反应2A(g)+B(g)?3C(g)+D(g),△H=akJ/mol.反应过程中的能量变化如图所示.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烯酸甲酯和甲醇 | B. | 对硝基甲苯和含硝酸的水层 | ||
| C. | 硝酸钾和氯化钠 | D. | 氯化铵和碳酸铵 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为消除碘缺乏症,我国卫生部门规定食盐中必须加碘,其中碘元素以KI形式存在 | |
| B. | 空气污染日报中的空气污染指数的主要项目有可吸入颗粒物、二氧化硫、二氧化氮和二氧化碳 | |
| C. | 用含橙色的酸性重铬酸钾溶液的仪器检验酒驾,利用了乙醇的挥发性和还原性 | |
| D. | 为了获得更好的消毒效果,医用酒精的浓度通常为95% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com