
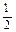 O2(g) =" CO" (g)
O2(g) =" CO" (g) 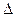 H1= —110.5kJ/mol
H1= —110.5kJ/mol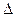 H2= —393.5kJ/mol
H2= —393.5kJ/mol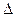 H为
H为| A.+ 283.5kJ/mol | B.+ 172.5kJ/mol |
| C.—172.5kJ/mol | D.—504kJ/mol |
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.由于红磷转化为白磷是放热反应,等质量的红磷能量比白磷低 |
| B.稀硫酸与稀NaOH溶液反应的中和热△H=57.3 kJ/mol |
| C.碳的燃烧热大于-110.5 kJ/mol |
| D.稀醋酸与稀NaOH溶液反应生成1 mol水,△H 大于 -57.3 kJ/mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 物 质 | 燃烧热(kJ·mol-1) |
| H2(g) | -285.8 |
| CO(g) | -283.0 |
| CH4(g) | -890.3 |
 。
。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2SO3(g);△H =" a" kJ/mol,反应过程的能量变化如图所示。已知1mol SO2(g)完全转化为1mol SO3(g)放热99kJ。请回答:
2SO3(g);△H =" a" kJ/mol,反应过程的能量变化如图所示。已知1mol SO2(g)完全转化为1mol SO3(g)放热99kJ。请回答: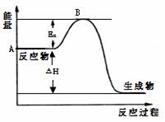
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 4NO(g)+6H2O(g); △H=-905 kJ/mol……①
4NO(g)+6H2O(g); △H=-905 kJ/mol……① 2N2(g)+6H2O(g);△H =-1268 kJ/mol……②,
2N2(g)+6H2O(g);△H =-1268 kJ/mol……②,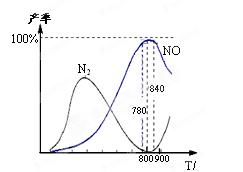
| A.工业上进行氨催化氧化生成 NO时,温度应控制在780~840℃之间 |
| B.工业上采用物料比n(O2)/n(NH3)在1.7~2.0,主要是为了提高反应速率 |
| C.在加压条件下生产能力可提高5~6倍,是因为加压可提高转化率 |
D.氮气氧化为NO的热化学方程式为:N2(g)+O2(g) 2NO(g) 2NO(g) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.有10 NA个电子转移时,吸收1300 kJ的能量 |
| B.有NA个C2H2分子参加反应时,放出1300 kJ的能量 |
| C.有NA个二氧化碳分子生成时,放出1300 kJ的能量 |
| D.有NA个水分子生成时,吸收1300 kJ的能量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
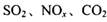 是对环境影响较大的儿种气体,对它们的合理控制和治理是优化我们生存环境的有效途径。
是对环境影响较大的儿种气体,对它们的合理控制和治理是优化我们生存环境的有效途径。 浓度的有__________ (选填字母)。
浓度的有__________ (选填字母)。


 条件下,
条件下,
 ,其平衡常数K=13.3。
,其平衡常数K=13.3。 ,则
,则 =_______________(保留两位有效数字)。
=_______________(保留两位有效数字)。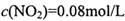 ,
, ,则改变的条件是____________________
,则改变的条件是____________________查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com