
【题目】某物质M能实现如下的转化,则M可能是
“![]() ”
”
A.NH3B.Na2CO3C.Al2O3D.FeO
科目:高中化学 来源: 题型:
【题目】硫酸亚铁(FeSO4·7H2O)是一种重要的食品和饲料添加剂。实验室通过如下实验由废铁屑制备FeSO4·7H2O晶体:
①将5%Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去Na2CO3溶液,然后将废铁屑用水洗涤2~3遍;
②向洗涤过的废铁屑中加入过量的稀硫酸,控制温度在50~80℃之间至铁屑耗尽;
③ ,将滤液转入到密闭容器中,静置、冷却结晶;
④待结晶完毕后,滤出晶体,用少量冰水洗涤2~3次,再用滤纸将晶体吸干;
⑤将制得的FeSO4·7H2O晶体放在一个小广口瓶中,密闭保存。
请回答下列问题:
(1)实验步骤①的目的是____。
(2)写出实验步骤②中的化学方程式____。
(3)补全实验步骤③的操作名称____。
(4)实验步骤④中用少量冰水洗涤晶体,其目的是___。
(5)乙同学认为甲的实验方案中存在明显的不合理之处,你___(填“是”或“否”)同意乙的观点。
(6)丙同学经查阅资料后发现,硫酸亚铁在不同温度下结晶可分别得到FeSO4·7H2O、FeSO4·4H2O和FeSO4·H2O。硫酸亚铁在不同温度下的溶解度和该温度下析出晶体的组成如下表所示(仅在56.7℃、64℃温度下可同时析出两种晶体)。
硫酸亚铁的溶解度和析出晶体的组成

若需从硫酸亚铁溶液中结晶出FeSO4·4H2O,应控制的结晶温度(t)的范围为___。
(7)取已有部分氧化的绿矾固体(硫酸亚铁的相对原子质量用M表示)wg,配制成100mL用cmol/L KMnO4标准溶液滴定,终点时消耗标准液的体积为VmL,则:若在滴定终点读取滴定管读数时,俯视滴定管液面,使测定结果___(填“偏高”、“偏低”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香族化合物A(![]() )是重要的有机化工原料。由A制备有机化合物F的合成路线(部分反应条件略去)如下图所示:
)是重要的有机化工原料。由A制备有机化合物F的合成路线(部分反应条件略去)如下图所示:
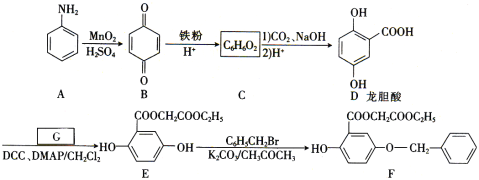
(1)A的分子式是______,B含有的官能团的名称是_________。
(2)D→E的反应类型是_________。
(3)已知G能与金属钠反应,则G的结构简式为________。
(4)写出E→F的化学方程式:_________。
(5)龙胆酸D的同分异构体有多种,符合下列条件的有___种。写出其中一种核磁共振氢谱有六组峰的同分异构体的结构简式:____。
①能发生银镜反应;②与FeCl3溶液发生显色反应;③1mol该物质能与2mol Na2CO3反应。
(6)已知: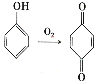 。参照上述合成路线,设计一条以苯酚、乙醇为原料制备龙胆酸乙酯(
。参照上述合成路线,设计一条以苯酚、乙醇为原料制备龙胆酸乙酯(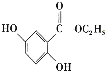 )的合成路线(无机试剂任用)。_________
)的合成路线(无机试剂任用)。_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是( )
A. N2(g)![]() NH3(g)
NH3(g)![]() NH4Cl(aq)
NH4Cl(aq)
B. Fe(s)![]() FeCl2(s)
FeCl2(s)![]() Fe(OH)2(s)
Fe(OH)2(s)
C. MgO(s)![]() MgSO4(aq)
MgSO4(aq)![]() Mg(s)
Mg(s)
D. S(s)![]() SO2(g)
SO2(g)![]() BaSO3(s)
BaSO3(s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁铬氧化还原液流电池是一种低成本的储能电池,电池结构如图所示,工作原理为Fe3++Cr2+![]() Fe2++Cr3+。下列说法正确的是( )
Fe2++Cr3+。下列说法正确的是( )
![]()
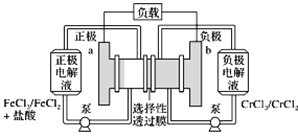
A. 电池放电时,a极的电极反应式为Fe3++3e===Fe
B. 电池放电时,电路中每通过0.1 mol电子,Fe3+浓度降低0.1 mol·L1
C. 电池充电时,Cl从a极穿过选择性透过膜移向b极
D. 电池充电时,b极的电极反应式为Cr3++e===Cr2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素 A、B、C、D、E、F 六种元素,它们的原子序数由 A 到 F依次增大。在周期表中,A 的原子半径最小。B 元素的原子最外层电子数是内层电 子数的两倍,C 为地壳中含量最多的元素,D 是原子半径最大的短周期主族元素,D 单质燃烧时呈现黄色火焰,D 的单质在高温下与 C 的单质充分反应,可以得到与 E 单质颜色相同的淡黄色固态化合物。D 与 F 形成的化合物 DF 是常用的调味品。试根 据以上叙述回答:
(1)元素符号:A____________、B____________、C____________、D____________。
(2)E 在元素周期表中的位置:_____________________。
(3)F 离子结构示意图:______________________。
(4)A、B 组成的最简单化合物的名称是_____。
(5)C 、D 按原子个数比 1∶1 组成的一种化合物与水发生反应的化学方程式为_____________________。
(6) 能说明 E 的非金属性比 F 的非金属性_____( 填“强”或“弱”) 的事实是____(举一例)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,容器内某一反应种M、N的物质的量随反应时间变化的曲线如下图,下列表述中正确的是
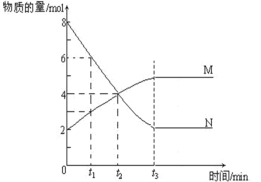
A.t2时,正逆反应速率相等,达到平衡
B.t3时间以后,正反应速率大于逆反应速率
C.t1时N的浓度是M的两倍
D.达到平衡时,N的浓度与M的浓度相等且不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究Cu和浓硫酸的反应,下列装置或操作正确的是

A. 用装置甲、乙制备SO2和收集SO2
B. 用装置甲、丙制备SO2和稀释CuSO4溶液
C. 用装置乙、丁收集SO2和检验SO2的漂白性
D. 用装置甲、丁制备SO2和探究SO2的漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水提镁的主要流程如下,下列说法正确的是

①试剂M是盐酸 ②流程中的反应全部都是非氧化还原反应
③操作b只是过滤 ④用海水晒盐后的饱和溶液加石灰乳制Mg(OH)2
⑤采用电解法冶炼镁是因为镁很活泼
A. ①②③④⑤ B. ②③ C. ④⑤ D. ①④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com