��������淋Ļ�ѧʽΪ��NH
4��
2Fe��SO
4��
2?6H
2O����Ʒ��ΪĦ���Σ������������������������������泥�һ�������������ڿ������ױ����������γ�Ħ���κ�ͱȽ��ȶ��ˣ������ε��ܽ�ȣ���λΪg/100gˮ�����±�
| �¶�/�� |
10 |
20 |
30 |
40 |
50 |
70 |
| ��NH4��2SO4 |
73.0 |
75.4 |
78.0 |
81.0 |
84.5 |
91.9 |
| FeSO4?7H2O |
40.0 |
48.0 |
60.0 |
73.3 |
- |
- |
| ��NH4��2Fe��SO4��2?6H2O |
18.1 |
21.2 |
24.5 |
27.9 |
31.3 |
38.5 |
ʵ�������Ʊ���������茶��壬��������·�����
��1�����ʵ�鲽���е���գ�
�ٳ�ȡ4g��м������С�ձ�������15mL10%Na
2CO
3��Һ��С�����10min�Գ�ȥ
����������
����������
��������Һ��������ˮ������ϴ�ɾ���������ã�
�ڽ������õ���м����С�ձ�������15mL 3mol/L H
2SO
4��Һ��ˮԡ��������������������Ϊֹ�����ȹ���ȥʣ����м������������ˮϴ���ձ�����ֽ��������Һ��ϴ��Һһ��ת�Ƶ��������У�������������Һ������Ϊ
��������
��������
�������ƣ�������ˮ�⣩�������ʵ���ԼΪ
0.045
0.045
mol��
�ۼ���
5.94
5.94
g����淋��������У��������ȡ�Ũ����������ֽᾧĤΪֹ����ȴ������������茶��壮
��2���ش��������⣺
������������Һ�ڿ������ױ��������ʣ�����ʱӦע�⣺a
����ϴ�Ӳ����ٶ�Ҫ��
����ϴ�Ӳ����ٶ�Ҫ��
��b
�����Ҫ�������ȣ��������
�����Ҫ�������ȣ��������
��
�ڼ��ȡ�Ũ����Һʱ����Ũ�����ɵ�������
��Ϊ����������������茶��壬���нᾧˮ�����ɻ�ʹ����ֽ�
��Ϊ����������������茶��壬���нᾧˮ�����ɻ�ʹ����ֽ�
��
����������������淋Ļ����Һ����Ũ�����ܵõ���������茶��壬��ԭ����
��Ϊ��ͬ�¶�����������茶�����ˮ�е��ܽ�ȱ���������������淋��ܽ��С
��Ϊ��ͬ�¶�����������茶�����ˮ�е��ܽ�ȱ���������������淋��ܽ��С
��
�ܳ�ȡ����������Ϊ1.96g�ĸ���������泥��Ƴ���Һ����δ֪Ũ�ȵ�KMnO
4������Һ���еζ���
�� �ζ�ʱ����KMnO
4������Һװ��
��ʽ
��ʽ
����ʽ���ʽ���ζ��ܣ�����ʱ��
��
��
������ƿ��
�� ��֪MnO
4-����ԭΪMn
2+����д���õζ������е����ӷ���ʽ��
5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
��
�� �жϸ÷�Ӧ����ζ��յ������Ϊ
���μ����һ����Һ����Һ����Ϻ�ɫ��30S�ڲ���ɫ��˵���ﵽ�ζ��յ�
���μ����һ����Һ����Һ����Ϻ�ɫ��30S�ڲ���ɫ��˵���ﵽ�ζ��յ�
��
���� ���赽��ζ��յ�ʱ����ȥV mL KMnO
4������Һ�����KMnO
4������Һ��Ũ��Ϊ
mol/L��

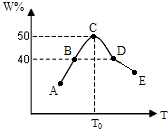 ��5�����ʵ�����Ϊ2.0mol��X��Y��ϣ��ֱ�����¶Ȳ�ͬ���ݻ���ͬ����Ϊ2L���ĺ��������з�����Ӧ2X��g��+Y��g��?3W��g����������ͬʱ��10sʱ�����������W������ٷֺ�����W%�����¶ȣ�T���仯�Ĺ�ϵ��ͼ��
��5�����ʵ�����Ϊ2.0mol��X��Y��ϣ��ֱ�����¶Ȳ�ͬ���ݻ���ͬ����Ϊ2L���ĺ��������з�����Ӧ2X��g��+Y��g��?3W��g����������ͬʱ��10sʱ�����������W������ٷֺ�����W%�����¶ȣ�T���仯�Ĺ�ϵ��ͼ��

 ��ս�п�����ϵ�д�
��ս�п�����ϵ�д�
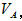 �к���һ����Һ������������Ϊ
�к���һ����Һ������������Ϊ ����
���� ��
��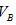 �Ĺ�ϵ��__________ ��
�Ĺ�ϵ��__________ �� ��
��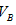 �Ĺ�ϵ��__________ ��
�Ĺ�ϵ��__________ ��