
| A. | 该反应化学方程式为CO+H2O?CO2+H2 | |
| B. | 该反应为吸热反应 | |
| C. | 升高温度,逆反应速率减小 | |
| D. | 无论采取怎样的措施该体系中混合气体的平均分子量都不会发生改变 |
分析 化学平衡常数,是指在一定温度下,可逆反应达到平衡时,各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,某反应达到平衡,平衡常数K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$,可知该可逆反应为CO2(g)+H2(g)?CO(g)+H2O(g),恒容时,温度升高,H2的浓度减小,说明平衡向正反应移动,该反应正反应为吸热反应.
A、反应达到平衡,平衡常数K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$,可知该可逆反应为CO2(g)+H2(g)?CO(g)+H2O(g);
B、恒容时,温度升高,H2的浓度减小,说明平衡向正反应移动,升高温度平衡向吸热反应移动;
C、升高温度,反应物、生成物的活化分子增多,正、逆反应速率都增大;
D、该反应前后气体的体积不发生变化,恒温恒容时,加入不反应的气体,增大压强,平衡不移动,H2的浓度不变;增大氢气的浓度,增大压强,平衡向正反应移动,平衡是氢气的浓度增大,与增大压强的方法有关.
解答 解:A、平衡常数K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$,可知该可逆反应为CO2(g)+H2(g)?CO(g)+H2O(g),故A错误;
B、恒容时,温度升高,H2的浓度减小,说明平衡向正反应移动,该反应正反应为吸热反应,即反应的焓变为正值,故B正确;
C、升高温度,反应物、生成物的活化分子增多,正、逆反应速率都增大,故C错误;
D、恒温恒容时,增大氢气的浓度,增大压强,平衡向正反应移动,平衡时氢气的浓度增大,故D错误.
故选B.
点评 本题考查外界条件对化学平衡的影响、化学平衡常数等,难度中等,注意对化学平衡常数的理解,同一反应,化学计量数不同,平衡常数不同.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:实验题
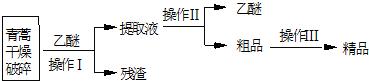
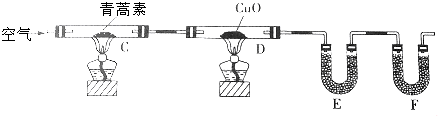
| 装置 | 实验前/g | 实验后/g |
| E | 22.6 | 42.4 |
| F | 80.2 | 146.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

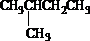
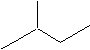

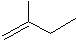
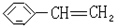 苯乙烯
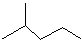
苯乙烯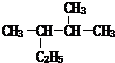 2,3-二甲基戊烷
2,3-二甲基戊烷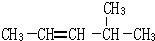 4-甲基-2戊烷
4-甲基-2戊烷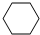 环己烷.
环己烷.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 空气质量日报列入的首要主要污染物有二氧化硫、二氧化氮和可吸入颗粒物等 | |
| B. | 酸雨是指pH小于7的雨水 | |
| C. | 为了减少二氧化硫和二氧化氮的排放,工业废气排放到大气之前必须进行回收处理 | |
| D. | 含磷合成洗涤剂直接排放会导致水体污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4的摩尔质量是98g | |
| B. | 1mol O2的体积是22.4L | |
| C. | 18g H2O含有的原子总数为3NA | |
| D. | 0.1 mol•L-1 BaCl2溶液中,Cl-的物质的量浓度为0.1 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 电池工作时,负极附近溶液的pH升高 | |
| B. | 电路中转移2mol电子,理论上约消耗标准状况下空气56L | |
| C. | 电池工作时,电流由M极经外电路流向N极 | |
| D. | 电池总反应为4Al+3O2=2Al2O3、2Mg+O2=2MgO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 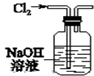 用图装置除去Cl2中混有的少量HCl | |
| B. | 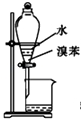 用图装置分离水和溴苯的混合物 | |
| C. | 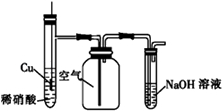 用图装置制备并收集NO气体 | |
| D. | 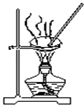 用图装置蒸干AlCl3饱和溶液制备AlCl3晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3、PH3、AsH3 | B. | SiH4、PH3、H2S | C. | HI、HBr、HCl | D. | H2S、HCl、AsH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com