
用FeCl3酸性溶液脱除H2S后的废液,通过控制电压电解得以再生。某同学使用石墨电极,在不同电压(x)下电解pH=1的0.1 mol/L FeCl2溶液,研究废液再生机理。记录如下(a、b、c代表电压值):
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅰ | x≥a | 电极附近出现黄色,有气泡产生 | 有Fe3+、有Cl2 |
| Ⅱ | a>x≥b | 电极附近出现黄色,无气泡产生 | 有Fe3+、无Cl2 |
| Ⅲ | b>x>0 | 无明显变化 | 无Fe3+、无Cl2 |
(1)用KSCN溶液检验出Fe3+的现象是________________________。
(2)Ⅰ中,Fe3+产生的原因可能是Cl-在阳极放电,生成的Cl2将Fe2+氧化。写出有关反应:________________________________________________________________________。
(3)由Ⅱ推测,Fe3+产生的原因还可能是Fe2+在阳极放电,原因是Fe2+具有________性。
(4)Ⅱ中虽未检验出Cl2,但Cl-在阳极是否放电仍需进一步验证。电解pH=1的NaCl溶液做对照实验,记录如下:
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅳ | a>x≥c | 无明显变化 | 有Cl2 |
| Ⅴ | c>x≥b | 无明显变化 | 无Cl2 |
①NaCl溶液的浓度是________mol/L。
②Ⅳ中检验Cl2的实验方法:_________________________________________________。
③与Ⅱ对比,得出的结论(写出两点):________________________________________
________________________________________________________________________。
解析:(1)SCN-与Fe3+发生反应生成Fe(SCN)3而使溶液变成红色,常根据这一颜色变化检验溶液中的Fe3+。
(2)实验Ⅰ中阳极附近出现黄色,有气泡产生,则该气体应为Cl2,Cl2将Fe2+氧化成Fe3+,有关反应为2Cl--2e-===Cl2,Cl2+2Fe2+===2Cl-+2Fe3+。
(3)电解过程中,阳极发生氧化反应,由于Fe2+具有还原性,若其浓度较大,可能在阳极失去电子发生氧化反应生成Fe3+。
(4)①pH=1的0.1 mol/L的FeCl2溶液中c(Cl-)=0.2 mol/L,若保证电解时溶液中c(Cl-)相同,则pH=1的NaCl溶液中c(NaCl)应为0.2 mol/L。
②Cl2具有强氧化性,可取少量阳极附近的溶液,滴在淀粉KI试纸上,试纸变蓝。
③对比实验Ⅱ和Ⅳ、Ⅴ可知,电极附近出现黄色可能是由于生成Fe3+、Cl2所致,通过控制电压,证实产生Fe3+的两种原因都成立,验证Fe2+先于Cl-放电。
答案:(1)溶液变红
(2) 2Cl--2e-===Cl2,Cl2+2Fe2+===2Cl-+2Fe3+
(3)还原
(4)①0.2
②取少量阳极附近的溶液,滴在淀粉KI试纸上,试纸变蓝
③通过控制电压,证实了产生Fe3+的两种原因都成立;通过控制电压,验证了Fe2+先于Cl-放电
点拨:知识:Fe3+的检验、Cl2与Fe2+的反应、Fe2+的化学性质、Cl2的检验方法等。能力:化学实验基本操作与基本技能;实验方案的设计、评价能力;分析、处理实验数据,得出实验结论的能力。试题难度:中等。


科目:高中化学 来源: 题型:
某主族元素的离子X2+有6个电子层,最外层有2个电子,当把XO2溶于浓盐酸时,有黄绿色气体产生,则下列说法正确的是
A.X2+具有强氧化性 B.X的最高正价为+2价
C.XO2具有强氧化性 D.该元素是ⅡA族
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验的操作、现象和解释或结论都正确的是( )
| 选项 | 操作 | 现象 | 解释或结论 |
| A | 向装有Fe(NO3)2溶液的试管中加入几滴稀H2SO4 | 溶液颜色基本不变 | Fe(NO3)2和H2SO4不反应 |
| B | 向饱和Na2CO3溶液中通入足量CO2 | 溶液变浑浊 | 析出了NaHCO3晶体 |
| C | 将Al2(SO4)3溶液蒸干 | 有白色固体生成 | Al3++3H2O Al(OH)3↓+3H+ |
| D | 将Na放入CuSO4溶液中 | 有红色固体析出 | 2Na+Cu2+===Cu+2Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学实验事实及其解释或结论都正确的是 ( )
A.用玻璃棒蘸取新制氯水,滴在pH试纸上,然后与比色卡对照,可测定新制氯水的pH
B.向10 mL 0.1 mol/L的AgNO3溶液中滴加10滴0.1 mol/L的NaCl溶液,有白色沉淀生成,再向其中滴加0.1 mol/L的KI溶液,沉淀变为黄色,说明相同温度下AgCl溶解度大于AgI的溶解度
C. 向1 mL 1%的NaOH溶液中加入2 mL 2%的CuSO4溶液,振荡,再加入0.5 mL有机物Y,加热,未出现砖红色沉淀,说明Y中不含醛基
D. 取少量卤代烃Y在碱性溶液中水解,用硝酸酸化至酸性,再滴加AgNO3溶液,生成淡黄色沉淀,说明卤代烃中含有溴元素
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机化合物的结构简式为 ,有关该化合物的叙述不正确的是( )
,有关该化合物的叙述不正确的是( )
A.该有机物的分子式为C11H12O2
B.1 mol该物质最多能与4 mol H2发生加成反应
C.该有机物能与热的新制氢氧化铜悬浊液反应,生成砖红色沉淀
D.该有机物一定条件下,可以发生取代、氧化、酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
分氧化的Fe、Cu合金样品(氧化产物为Fe2O3、CuO)共8.0 g,进行如下处理:
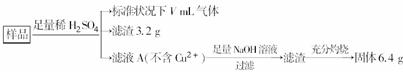
下列说法正确的是( )
A.滤液A中的阳离子为Fe2+、Fe3+、H+
B.样品中金属Fe的质量为4.48 g
C.样品中CuO的质量为4.0 g
D.V=1344
查看答案和解析>>
科目:高中化学 来源: 题型:
某卫生局在某饮料原液主剂配料中,检验出当地禁止掺入的碳酸饮料防腐剂“对羟基苯甲酸甲酯”。对羟基苯甲酸甲酯
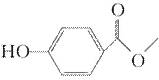 ( )又叫尼泊金甲酯,主要用作有机合成、食品、化妆品、
( )又叫尼泊金甲酯,主要用作有机合成、食品、化妆品、
医药的杀菌防腐剂,也用作饲料防腐剂。某课题组提出了如下合成路线:
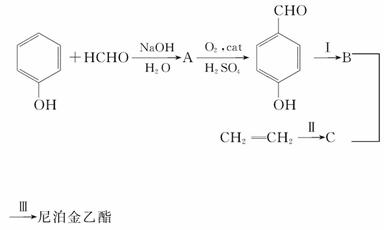
(1)尼泊金乙酯的分子式是_________________。
(2)反应Ⅰ的反应类型是________;反应Ⅱ的反应类型是______________。
(3)写出结构简式:
A______________、B______________。
(4)写出反应Ⅲ的化学方程式______________________________________。
(5)尼泊金乙酯有多种同分异构体,写出同时符合下列条件的同分异构体的结构简式为________________________________________________________。
①属于酚类;②苯环上有两个互为对位的取代基;③能发生水解反应,也可以发生银镜反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com