
����Ŀ�������Ѿ��ܷⴢ��ʱ��Խ��������Խ�ã�ԭ��֮һ�Ǵ������������������ζ��������ʵ����Ҳ����������ͼ��ʾ��װ����ȡ������������ش��������⡣
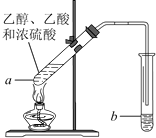
(1)�Ҵ������й����ŵ�������_______��
�����еĹ����ŵĽṹ��ʽ ________��
(2)�Թ�a�м��뼸�����Ƭ��Ŀ����____________��
(3)�Թ�a�з�����Ӧ�Ļ�ѧ����ʽΪ_______________________����Ӧ������__________��
(4)��Ӧ��ʼǰ���Թ�b��ʢ�ŵ���Һ��____________��
(5)����____________�ķ������Ƶõ������������������
(6)Ũ��������� _______________________��
���𰸡� �ǻ� ��COOH ��ֹ���� CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O ������ȡ���� ����̼������Һ ��Һ ��������ˮ��
CH3COOCH2CH3+H2O ������ȡ���� ����̼������Һ ��Һ ��������ˮ��
��������(1)���Ĺ��������ǻ����Ҵ��к����ǻ�������Ĺ��������Ȼ����Ȼ��Ľṹ��ʽΪ-COOH���ʴ�Ϊ���ǻ���-COOH��
(2)�Թ�a�м��뼸�����Ƭ���Է�ֹ���У��ʴ�Ϊ����ֹ������
(3)�������Ҵ���Ũ���������¼��ȷ���������Ӧ��������������ˮ��ͬʱ�÷�Ӧ���棬
��Ӧ�Ļ�ѧ����ʽΪCH3COOH+CH3CH2OH![]() CH3COOC2H5+H2O���ʴ�Ϊ��CH3COOH+CH3CH2OH
CH3COOC2H5+H2O���ʴ�Ϊ��CH3COOH+CH3CH2OH![]() CH3COOC2H5+H2O��
CH3COOC2H5+H2O��
(4)�Ʊ���������ʱ���ñ���̼������Һ����������������ȥ�Ҵ������ᡢ���������������ܽ�ȣ����ڷֲ㣬�ʴ�Ϊ������̼������Һ��
(5)�������������ڱ���̼������Һ�����÷�Һ�������룬�ʴ�Ϊ����Һ��
(6)��ʵ����Ũ���������Ϊ��������ˮ�����ʴ�Ϊ����������ˮ����


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ����٤��������ֵ������˵����ȷ����
A. 100 mL 0.2 mol��L-1������Һ��������������Ϊ0. 02 NA
B. 40 mL 10 mol��L-1��Ũ������������MnO2��ַ�Ӧ�����������ķ�����Ϊ0.1 NA
C. ��״���£�22.4 L CHCl3�к��е���ԭ����ĿΪ3 NA
D. 14 g CO��N2��������к��еĵ�������Ϊ7 NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йس��ӷ�����ȷ����
A. ��ȥFe3+��Al3+�����������ˮ��ַ�Ӧ����
B. ��ȥFeCl3������CuCl2�������������ۣ�����
C. ��ȥNaHCO3��Һ�е�Na2CO3��ͨ�����CO2��ַ�Ӧ
D. ��ȥ�����е�þ�ۣ���������������������Һ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧʵ��С���ͬѧΪ̽���ͱȽ�SO2����ˮ��Ư���ԣ���������µ�ʵ��װ�á�

��1��ʵ������װ��E�Ʊ�Cl2�����ӷ���ʽΪ__________________��
��2���ٷ�Ӧ��ʼһ��ʱ��۲쵽B��D�����Թ��е�Ʒ����Һ���ֵ������ǣ� B��______________��D��_________��
��ֹͣͨ����,�ٸ�B��D�����Թֱܷ���ȣ������Թ��е�����ֱ�Ϊ
B��____________��D��_________________��
��3����һ��ʵ��С���ͬѧ��ΪSO2����ˮ����Ư���ԣ�����Ϻ��Ư���Կ϶����ǿ�����ǽ��Ƶõ�SO2��Cl2��1��1ͬʱͨ�뵽Ʒ����Һ�У����������ɫЧ���������������������������������ԭ���û�ѧ����ʽ��ʾ��________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ܽ�����μ���һ��Һ�壬����ʹ�ܽ��������۶���������������ʹ������ʧ������Һ������ ��
A. 0.5mol/L����������Һ B. 0.5mol/L����
C. 0.5mol/L�Ȼ�����Һ D. ����ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������̼̼������˫��������л���ɿ����С�����ṹ�����������ֽṹ���ǣ� ��
A.����ϩ
B.1��3��������ϩ
C.��Ȼ��
D.����Ȳ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȼú�����ĸĽ��������ں�����������ЧӦ��������Ⱦ�����ܽ�����Դ�����ã��������»��ȼ�ϻ���Ҫ��ҵ��Ʒ����ҵ����ú��ˮΪԭ��ͨ��һϵ��ת����Ϊ�����Դ������ҵԭ�ϼ״���
��1����̼��ȼ����Ϊ393.5kJ��mol-1��������ȼ����Ϊ285.8kJ��mol-1����֪��Ӧ
C(s)+2H2O(g) ![]() CO2(g)+2H2(g) ��H��0���ܷ�����÷�Ӧ�ġ�H_______����ܡ����ܡ�����������������H����������˵�����ɣ���_____________________��
CO2(g)+2H2(g) ��H��0���ܷ�����÷�Ӧ�ġ�H_______����ܡ����ܡ�����������������H����������˵�����ɣ���_____________________��
��2����ҵ��Ҳ����������������Ӧ�õ���CO2��H2��һ���ϳɼ״�����Ӧ����ʽΪ��
CO2(g)��3H2(g)![]() CH3OH(g)��H2O(g�� ��H��0
CH3OH(g)��H2O(g�� ��H��0
�ٹ�ҵ����������CO2��H2��ת����________���ǰ�ߴ������ߴ���һ�������жϡ�����Ϊ����״��IJ��ʿ��Բ�ȡ�Ĵ�ʩ��____________��____________�������㣩��
����һ���º����ܱ������г���1 mol CO2��3 mol H2����������Ӧ�����CO2��CH3OH(g)Ũ����ʱ��仯��ͼ��ʾ��
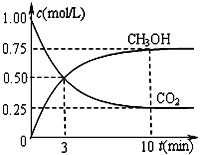
i����H2��ʾ0-3min�ڸ÷�Ӧ��ƽ����Ӧ����______________��
ii�����¶��µ�ƽ�ⳣ��Ϊ__________________��10 min�����¶Ȳ��䣬����ܱ��������ٳ���1 mol CO2(g)��1 mol H2O(g)����ʱV�� _________V�������������������������
iii�����ڻ�Ԫ��ӦaA+bB![]() cC+dD���ԣ���ijһʱ�̵�˲ʱ���ʼ��㹫ʽ���£�����Ӧ����ΪV��=k����c(A)a��c(B)b ���淴Ӧ����ΪV��=k����c(C)c��c(D)d������k����k��Ϊ���ʳ���������������Ӧ��Ϊ��Ԫ��Ӧ��������������k����k��=_________����Ӧ���е���3 minʱV�� ��V�� ��________��
cC+dD���ԣ���ijһʱ�̵�˲ʱ���ʼ��㹫ʽ���£�����Ӧ����ΪV��=k����c(A)a��c(B)b ���淴Ӧ����ΪV��=k����c(C)c��c(D)d������k����k��Ϊ���ʳ���������������Ӧ��Ϊ��Ԫ��Ӧ��������������k����k��=_________����Ӧ���е���3 minʱV�� ��V�� ��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ��ѧƽ��״̬��ϵ�У������������ı仯������һ����ʹƽ�ⷢ���ƶ����ǣ� ��
A. ��Ӧ���ת���� B. ��Ӧ���Ũ��
C. �����淴Ӧ���� D. ��ϵ��ѹǿ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com