
 2CaSO4+2CO2
2CaSO4+2CO2 Na2SiO3+CO2��
Na2SiO3+CO2�� 2CaSO4+2CO2����A��ȷ��
2CaSO4+2CO2����A��ȷ�� Na2SiO3+CO2������C��ȷ��
Na2SiO3+CO2������C��ȷ��


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 ��ѧѧ���е�ƽ��������Ҫ��������ѧƽ�⡢����ƽ�⡢ˮ��ƽ����ܽ�ƽ�����֣��Ҿ�������������ԭ������ش��������⣺
��ѧѧ���е�ƽ��������Ҫ��������ѧƽ�⡢����ƽ�⡢ˮ��ƽ����ܽ�ƽ�����֣��Ҿ�������������ԭ������ش��������⣺| c(CH3OH) |
| c(CO)��c2(H2) |
| c(CH3OH) |
| c(CO)��c2(H2) |
| 2nB |
| 3tB |
| 2nB |
| 3tB |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| 312 |
| a3NA |
| 312 |
| a3NA |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
��ѧѧ���е�ƽ��������Ҫ��������ѧƽ�⡢����ƽ�⡢ˮ��ƽ����ܽ�ƽ�����֣��Ҿ�������������ԭ������ش��������⣺
��1�����ڿ��淴ӦmA��g��+nB��g�� ![]() pC��g��+qD��g����ƽ��ʱ��V��=k1c��A��mc��B��n��K1Ϊ���ʳ���������ƽ��ʱ��ѧƽ�ⳣ��ΪK2����K1��K2ֻ���¶��йء��ֽ�4molSO2��2molO2�������Ϊ2L���ܱ������У�500����з�Ӧ�������¶Ȳ��䣬��Ӧ�ﵽƽ��ʱ��SO2��ת����Ϊ50��������ʼʱ����Ӧ������ƽ��ʱ�� ����500��ʱ���÷�Ӧ��ƽ�ⳣ��K2�� �����¶Ȳ���ʱ������ƽ����ϵ�м���2molSO2��2molO2��4molSO3��ƽ�⽫�� �ƶ���
pC��g��+qD��g����ƽ��ʱ��V��=k1c��A��mc��B��n��K1Ϊ���ʳ���������ƽ��ʱ��ѧƽ�ⳣ��ΪK2����K1��K2ֻ���¶��йء��ֽ�4molSO2��2molO2�������Ϊ2L���ܱ������У�500����з�Ӧ�������¶Ȳ��䣬��Ӧ�ﵽƽ��ʱ��SO2��ת����Ϊ50��������ʼʱ����Ӧ������ƽ��ʱ�� ����500��ʱ���÷�Ӧ��ƽ�ⳣ��K2�� �����¶Ȳ���ʱ������ƽ����ϵ�м���2molSO2��2molO2��4molSO3��ƽ�⽫�� �ƶ���
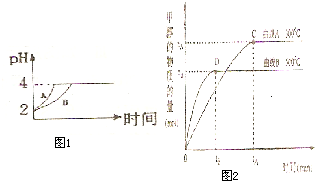
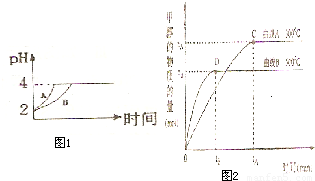
��2�������£�ȡpH=2������ʹ�����Һ��100mL�������зֱ����������Zn������Ӧ����������Һ��pH�仯����ͼ��ʾ����ͼ�б�ʾ������Һ��pH�仯���ߵ��� ���A����B������
�������м����Zn����Ϊm1��������Һ�м����Zn����Ϊm2����m1 m2��ѡ�<������=������>������

��3�����ܵ������ˮ��Һ�д����ŵ���ƽ�⡣�ڳ����£���Һ�������Ũ�������ǻ�ѧ������Ϊ���εij˻���һ�����������ܶȻ�������KSP��������Һ�и�����Ũ�ȷ��εij˻������ܶȻ�ʱ���������������֮�����ܽ⡣��֪������Cu��OH��2���ܶȻ�Ϊ2��10![]() ����ijCuSO4��Һ�c��Cu2+��=0��02mol��L���������Cu��OH��2������Ӧ������ҺpH��ʹ֮���� ��Ҫʹ0��2mol��L��CuSO4��Һ��Cu2+������Ϊ��ȫ��ʹCu2+Ũ�Ƚ���ԭ����ǧ��֮һ����Ӧ����Һ���NaOH��Һ��ʹ��ҺpHֵΪ ��
����ijCuSO4��Һ�c��Cu2+��=0��02mol��L���������Cu��OH��2������Ӧ������ҺpH��ʹ֮���� ��Ҫʹ0��2mol��L��CuSO4��Һ��Cu2+������Ϊ��ȫ��ʹCu2+Ũ�Ƚ���ԭ����ǧ��֮һ����Ӧ����Һ���NaOH��Һ��ʹ��ҺpHֵΪ ��
��4�������£�ij���Na2CO4����Һ�е����̪����Һ�ʺ�ɫ�������Һ�� �ԡ��ڷ�������Һ����̪�ʺ�ɫԭ��ʱ����ͬѧ��Ϊ��������Һ���õĴ�����Ʒ�л���NaOH��������ͬѧ��Ϊ����Һ��Na2CO3�������CO![]() ˮ���������������һ����ʵ�鷽����������λͬѧ��˵�������У���������������ͽ��ۣ� ��
ˮ���������������һ����ʵ�鷽����������λͬѧ��˵�������У���������������ͽ��ۣ� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2007-2008ѧ��ɽ��ʡ��������ˮ�ظ������ϣ���ĩ��ѧ�Ծ��������棩 ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com