
| A. | 凡含有食品添加剂的食物对人体健康均有害 | |
| B. | 苹果放在空气中久置变黄和纸张久置变黄原理相似 | |
| C. | 黄河入海口沙洲的形成与用卤水点豆腐,都体现了胶体聚沉的性质 | |
| D. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 |
分析 A.按照食品法规定的符合添加剂标准的食物对人体健康无害;
B.纸张久置变黄因为纸张纤维间的空隙中会渗入很多霉菌之类的真菌孢子,苹果久置变黄是因为所含二价铁离子被氧化生成三价铁离子;
C.黄河中的泥沙和豆浆都是胶体,可溶性电解质能够使带电的胶体微粒发生聚沉;
D.根据聚酯纤维和光导纤维的成分分析.
解答 解:A.合理使用食品添加剂,对丰富食品生产和促进人体健康有好处,可以食用,但不能过量,故A错误;
B.纸张久置变黄因为纸张纤维间的空隙中会渗入很多霉菌之类的真菌孢子,苹果久置变黄是因为所含二价铁离子被氧化生成三价铁离子,二者原理不相同,故B错误;
C.黄河中的泥沙和豆浆都是胶体,胶体遇电解质溶液发生聚沉,故C正确;
D.因制作航天服的聚酯纤维属于有机物,不是新型无机非金属材料,故D错误;
故选C.
点评 本题考查食品添加剂、纤维素、胶体的聚沉、无机非金属材料等知识,难度中等,熟悉相关物质的性质,掌握其中的原理是解题关键,注意对基础知识的巩固.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:多选题
| A. | 0.1 mol•L-1CH3COONa溶液中:c(CH3COO-)+c(CH3COOH)═0.1 mol•L-1 | |
| B. | 25℃时,等物质的量浓度的各溶液pH关系为:pH(Na2CO3)>pH(C6H5ONa)>pH(NaHCO3)>pH(CH3COONa) | |
| C. | 25℃时,pH=9.4,浓度均为0.1 mol•L-1的HCN与NaCN的混合溶液中:c(Na+)>c(HCN)>c(CN-)>c(OH-) | |
| D. | 将足量AgCl分别放入:①5m水,②10mL0.2mol/LMgC12,③20mL0.3mol/L盐酸中溶解至饱和,c(Ag+):①>②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 用图(a)装置电解精炼铝 | |
| B. | 用图(b)装置制备Fe(OH)2 | |
| C. | 图(c)装置可制得金属钾 | |
| D. | 图(d)验证NaHCO3和Na2CO3的热稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-) | B. | c(SO42-)=c(NH4+)>c(Fe2+)>c(H+)>c(OH-) | ||
| C. | 2c(SO42-)+c(OH-)=c(NH4+)+2c(Fe2+)+c(H+) | D. | c(NH4+)+c(NH3•H2O)=2c(Fe2+)+2c[Fe(OH)2] |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
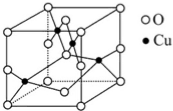 太阳能的开发利用在新能源研究中占据重要地位,单晶硅太阳能电池片在加工时,一般掺杂微量的铜、锎、硼、镓、硒等.回答下列问題:
太阳能的开发利用在新能源研究中占据重要地位,单晶硅太阳能电池片在加工时,一般掺杂微量的铜、锎、硼、镓、硒等.回答下列问題:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com