
| A. | 误将洁厕灵与消毒液混合:2H++Cl-+ClO-═Cl2↑+H2O | |
| B. | 玻璃试剂瓶被烧碱溶液腐蚀:SiO2+2Na++2OH-═Na2SiO3↓+H2O | |
| C. | 硝酸铝溶液中加入过量氨水:Al3++4NH3•H2O=AlO2-+4NH4++2H2O | |
| D. | 向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀:Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32- |
分析 A.酸性条件下氯离子与次氯酸根离子反应生成氯气和水;
B.二氧化硅与氢氧化钠溶液反应生成硅酸钠和水;
C.氨水为弱碱,二者反应生成氢氧化铝沉淀;
D.澄清石灰水过量,反应生成碳酸钙沉淀、氢氧化钠和水.
解答 解:A.误将洁厕灵与消毒液混合,盐酸与次氯酸发生氧化还原反应生成氯气和水,反应的离子方程式为:2H++Cl-+ClO-═Cl2↑+H2O,故A正确;
B.玻璃试剂瓶被烧碱溶液腐蚀,发生反应生成硅酸钠和水,正确的离子方程式为:SiO2+2OH-═SiO32-+H2O,故B错误;
B.硝酸铝溶液中加入过量的氨水,反应产物为氢氧化铝沉淀,正确的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故B错误;
D.向NaHCO3溶液中加入过量的澄清石灰水,反应生成碳酸钙沉淀、氢氧化钠和水,正确的离子反应为:Ca2++OH-+2HCO3-=CaCO3↓+H2O,故D错误;
故选A.
点评 本题考查了离子方程式的判断,题目难度不大,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等;试题侧重考查学生的规范答题能力.


科目:高中化学 来源: 题型:解答题
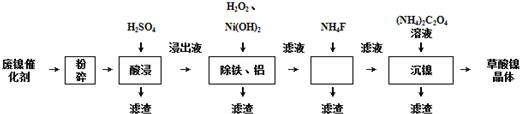
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Al3+ | 3.0 | 5.0 |
| Ni2+ | 6.7 | 9.5 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
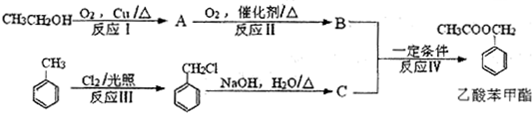
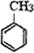 +Cl2$\stackrel{光照}{→}$
+Cl2$\stackrel{光照}{→}$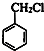 +HCl.
+HCl.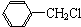 不能发生的化学反应是b(填序号).
不能发生的化学反应是b(填序号).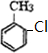 (写出一种即可).
(写出一种即可). .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 以石墨作电极电解饱和氯化钠溶液:2Cl-+2H2O$\stackrel{电解}{→}$ 2OH-+H2↑+Cl2↑ | |
| B. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+→Fe3++3H2O | |
| C. | H218O中投入少量Na2O2固体:2H218O+2O22-→4OH-+18O2↑ | |
| D. | CuCl2溶液中加入NaHS溶液:Cu2++HS-→CuS↓+H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁与盐酸反应放出氢气 | B. | 氢氧化钠与盐酸的反应 | ||
| C. | 浓硫酸与蔗糖混合 | D. | Ba(OH)2•8H2O与NH4Cl反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
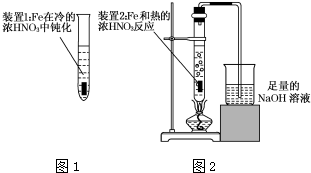 Fe、Cu都是人类较早使用的金属,某校化学研究性学习小组的同学运用实验的手段研究Fe、Cu以及化合物的相关性质.请你参与研究并回答下列问题:
Fe、Cu都是人类较早使用的金属,某校化学研究性学习小组的同学运用实验的手段研究Fe、Cu以及化合物的相关性质.请你参与研究并回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同温度下,溶液中水的电离程度:溶液①<溶液② | |
| B. | 可用Na2CO3固体鉴别0.04mol•L-1醋酸和0.04mol•L-1盐酸 | |
| C. | 向①中加入少量CH3COONa固体,则$\frac{{K}_{a}}{c(C{H}_{3}CO{O}^{-})}$增大 | |
| D. | 加水稀释溶液③,溶液中$\frac{c(C{H}_{3}COOH)•c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在一个基态多电子的原子中,不可能有两个能量完全相同的电子 | |
| B. | M层全充满而N层为4s2的原子与核外电子排布式为1s22s22p63s23p63d64s2的原子位于同一族 | |
| C. | 如果某一基态原子3p能级上仅有2个电子,它们的自旋状态必然相同 | |
| D. | 价电子排布为5s25p1的元素位于第五周期第ⅠA族,是s区元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com