
【题目】下列各组物质中,互为同素异形体的是
A.O2和O3B.CH3CH3和CH2=CH2
C.146C和136CD.CH3CH2CH3和CH3CH(CH2CH3)CH2CH3
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 酸性氧化物和碱性氧化物都是电解质
B. 将NaOH溶液逐滴加入FeCl3溶液可制备Fe(OH)3胶体
C. 电化学腐蚀是造成金属腐蚀的主要原因
D. 离子键一定只存在于离子化合物中,共价键一定只存在于共价化合物中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种新型的绿色能源,又是一种重要的化工原料。以生物材质 (以C 计)与水蒸气反应制取H2是种低耗能,高效率的制H2方法。该方法由气化炉制造H2和燃烧炉再生CaO两步构成。气化炉中涉及到的反应为:
I C(s)+H2O(g)![]() CO(g)+H2(g) K1;
CO(g)+H2(g) K1;
II CO(g)+H2O(g)![]() CO2(g)+H2(g) K2;
CO2(g)+H2(g) K2;
III CaO(s)+CO2(g)![]() CaCO3(s) K3;
CaCO3(s) K3;
燃烧炉中涉及到的反应为:
IV C(s)+O2(g)=CO2
V CaCO3(s)=CaO(s)+CO2(g)
(1)该工艺制H2总反应可表示为C(s)+2H2O(g)+CaO(s) ![]() CaCO3(s)+2H2(g),其反应的平衡常数K=__________(用K1、K2、K3的代数式表示)。在2L的密闭容器中加入一定量的C(s)、H2O(g)和CaO(s)。下列能说明反应达到平衡的是_______________________。
CaCO3(s)+2H2(g),其反应的平衡常数K=__________(用K1、K2、K3的代数式表示)。在2L的密闭容器中加入一定量的C(s)、H2O(g)和CaO(s)。下列能说明反应达到平衡的是_______________________。
A.容器内压强不再变化 B. H2与H2O(g)的物质的量之比不再变化
C.混合气体的密度不再变化 D.形成a molH-H键的同时断裂2amolH-O键
(2)对于反应I,不同温度和压强对H2产率影响如下表。
温度 | 压强p1/Mpa | 压强p2/Mpa |
500℃ | 45.6% | 51.3% |
700℃ | 67.8% | 71.6% |
下列图像正确的是__________________。

(3)已知反应Ⅱ的ΔH=-41.1kJ/mol,C=O、O-H、H-H的键能分别为 803 kJ/mol,464 kJ/mol、436 kJ/mol,则CO中碳氧键的键能为___________ kJ/mol。
(4)对于反应Ⅲ,若平衡时再充入CO2,使其浓度增大到原来的2倍,则平衡移动方向为___________;当重新平衡后,CO2浓度___________(填“变大”“ 变小”“ 不变”)。
(5)甲醇燃料电池是采用铂作电极催化剂,其工作原理的示意图如下:

请回答下列问题:
①Pt(a)电极是电池的_______极,电极反应式为______________________;
②常温下,用此电池以惰性电极电解0.5L饱和食盐水(足量),若两极共生成气体1.12L(已折算为标准状况下的体积),则电解后溶液的pH=_________(忽略溶液的体积变化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金银花有效活性成分为绿原酸,又名咖啡鞣酸,具有广泛的杀菌消炎功效,结构如图所示, 列有关绿原酸的说法正确的是( )
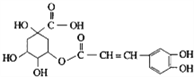
A. 绿原酸的分子式为C16H16O9 B. 1mol绿原酸最多与4molNaOH反应
C. 1个绿原酸分子中含有3个手性碳原子 D. 绿原酸分子中有4种化学环境不同的氢原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验的反应原理用离子方程式表示正确的是( )
A. 室温下,测得氯化铵溶液pH<7,证明一水合氨是弱碱:NH4++2H2O===NH3·H2O+H3O+
B. 用氢氧化钠溶液除去镁粉中的杂质铝:2Al+2OH-+2H2O===2AlO2-+3H2↑
C. 用碳酸氢钠溶液检验水杨酸中的羧基: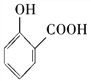 +2HCO3-→
+2HCO3-→ +2H2O+2CO2↑
+2H2O+2CO2↑
D. 用高锰酸钾标准溶液滴定草酸:2MnO4-+16H++5C2O4-=2Mn2++10CO2↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列说法错误的是
A. 碳酸钠可用于去除餐具的油污
B. 过氧化钠可用于羽毛的漂白
C. 氢氧化铝可用于中和过多胃酸
D. 碳酸钡可用于胃肠X射线造影检查
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述正确的是
A. 标准状况下,11.2 L水中含有的分子数是0.5NA
B. 常温常压下,17g氨气中所含原子数为NA
C. 1 mol OH- 中含有电子数为10NA
D. 1 mol/LBaCl2溶液中含有的氯离子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素周期表的叙述中正确的是
A. 除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数
B. 元素周期表共七个横行代表七个周期,18 个纵行代表18 个族
C. 主、副族元素的族序数从左到右都是依次由小到大排列(如ⅠB→ⅦB)
D. 除零族外,由长、短周期元素共同组成的元素族称为主族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)+6价铬的化合物毒性较大,常用NaHSO3将废液中的Cr2O![]() 还原成Cr3+,该反应的离子方程式为__________________________________________________________。
还原成Cr3+,该反应的离子方程式为__________________________________________________________。
(2)向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为____________________________________。
(3) “酸浸”时V2O5转化为VO![]() ,反应的离子方程式为________________________________________。
,反应的离子方程式为________________________________________。
(4)在H2SO4的酸性环境中ClO2与碘化钾反应的离子方程式___________________________。
(5)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com