
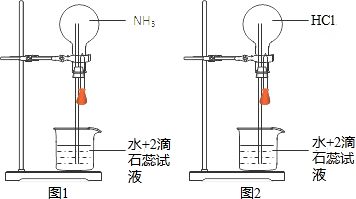
| A. | 所得溶液中溶质的物质的量浓度均为$\frac{1}{{V}_{m}}$mol•L-1 | |
| B. | “喷泉”结束时烧瓶内充满液体 | |
| C. | 图2可通过膨胀法引发“喷泉” | |
| D. | 图1、图2中喷泉的颜色分别为蓝色、红色 |
分析 A、设圆底烧瓶中氨气和HCl的体积均为VL,则喷泉实验后溶液体积为VL;
B、气体是用排空气法收集的,故气体中均有空气;
C、用手捂住图2的烧瓶,则气体会逸出;
D、氨气溶于水后显碱性;HCl溶于水后显酸性.
解答 解:A、设圆底烧瓶中氨气和HCl的体积均为VL,则氨气或HCl的物质的量为n=$\frac{V}{Vm}mol$,喷泉实验后溶液体积为VL,故所得溶液的浓度为c=$\frac{\frac{V}{Vm}mol}{VL}$=$\frac{1}{Vm}$mol/L,故A正确;
B、气体是用排空气法收集的,故气体中均有空气,故实验结束时烧瓶内液体不能充满,故B错误;
C、用手捂住图2的烧瓶,则气体会逸出,从而引起烧瓶内的压强减小,则引起喷泉,故C正确;
D、氨气溶于水后显碱性,遇石蕊变蓝;HCl溶于水后显酸性,遇石蕊变红,故D正确.
故选B.
点评 本题考查了氨气和HCl的喷泉实验,注意所得溶液浓度的计算方法,由于氨气和HCl均由排空气法收集,故喷泉实验后溶液不能充满整个烧瓶.


科目:高中化学 来源: 题型:选择题
| A. | a-4 | B. | a+8 | C. | a-5 | D. | a+4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CS2是非极性分子 | B. | CS2的沸点高于CO2 | ||
| C. | CS2不能在空气中燃烧 | D. | CS2能证明非金属性S>C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 24g镁的原子最外层电子数为NA | |
| B. | 0.3mol O2与一定量的Fe3+在一定条件下完全反应,生成Fe2O3和Fe3O4的混合物,则转移电子数为1.2mol | |
| C. | 2L 0.1mol/L氯化铁溶液中含有Fe的数目为0.2NA | |
| D. | 1L水中溶解了58.5gNaCl,该溶液的物质的量浓度为1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KSCN溶液:酸性KMnO4溶液 | B. | NaOH溶液:Fe粉 | ||
| C. | KSCN溶液:NaOH溶液 | D. | 氨水:NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 反应过程 | 反应现象 | 离子方程式 |
| A | 金属镁与稀盐酸反应 | 有气泡逸出 | Mg+2H++2C-═MgCl2+H2↑ |
| B | 氣化钡溶液与稀硫酸反应 | 有白色沉淀生成 | Ba2++SO42-═BaS04↓ |
| C | 碳酸钠与盐酸反应 | 有气泡逸出 | Na2C03+2H+═CO2↑+H20+ 2Na+ |
| D | 硫酸铜溶液中加入过量的NaOH溶液 | 有白色沉淀产生 | Cu2++20H-═Cu(0H)2↓ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com