
 (1)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:
(1)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | C1 | C2 | C3 | C3 |
| 4 | C1 | C2 | C3 | C3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
分析 (1)根据v=$\frac{c}{△t}$计算v(H2O);
(2)化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物的浓度系数次幂之积与反应物的浓度系数次幂之积的比,固体、纯液体不需要在化学平衡常数中写出;
(3)可逆反应到达平衡时,各组分的浓度保持不变.
解答 解:(1)0~4min内水浓度变化为0.3mol/L-0.18mol/L=0.12mol/L,故v(H2O)=$\frac{0.12mol/L}{4min}$=0.03mol/(L.min),
故答案为:0.03mol;
(2)CO(g)+H2O(g)?CO2(g)+H2(g)的平衡常数表达式K=$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$,
故答案为:$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$;
(3)由表中数据可知,3min、4min时都应个组分的浓度相同,故处于平衡状态,
故答案为:3min~4min.
点评 本题考查化反应速率计算、平衡常数、平衡状态特征等,比较基础,注意故基础知识的理解掌握.


科目:高中化学 来源: 题型:选择题
| A. | 石墨比金刚石稳定 | |
| B. | 1mol石墨和金刚石完全燃烧时释放的能量石墨比金刚石少 | |
| C. | 金刚石与石墨的性质相似 | |
| D. | 1mol金刚石比1mol石墨的总能量高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用Cl2与石灰石反应制取漂白粉 | |
| B. | 漂白粉中含有HClO,因而具有漂白作用 | |
| C. | 漂白粉的成份为次氯酸钙和氯化钙 | |
| D. | 由于漂白粉属于固体试剂不需要密封保存 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S(s)+O2(g)═SO2(g)△H=-296.8 kJ/mol(反应热) | |
| B. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=+57.3 kJ/mol(中和热) | |
| C. | C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g)△H=-1 367.0 kJ/mol(燃烧热) | |
| D. | 2NO2═O2+2NO△H=+116.2 kJ/mol(反应热) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
A、利用该装置准确量取9.20ml硫酸溶液 | B、将洗涤液转移到容量瓶中,应该采取如图的操作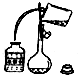 |
| C、过滤和蒸发中都需要使用玻璃棒,且玻璃棒的用途一样 | D、保存NaOH应使用带橡皮塞的玻璃试剂瓶 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com